

正文
環(huán)丙烷獨特的結(jié)構(gòu)特征和反應(yīng)活性長期以來一直是有機化學領(lǐng)域的研究重點。這種具有高度環(huán)張力的三元碳環(huán)結(jié)構(gòu)能夠與親核試劑、親電試劑以及自由基化合物發(fā)生多種反應(yīng)。此外,環(huán)丙烷的構(gòu)象剛性特征及其取代基在空間排列上的高度定向性,使其成為藥物化學研究中至關(guān)重要的藥效團結(jié)構(gòu)單元。在有機合成中,烯烴的環(huán)丙烷化反應(yīng)是構(gòu)建環(huán)丙烷骨架最常用的方法之一。而傳統(tǒng)的烯烴直接環(huán)丙烷化方法無法修飾烯烴α-碳或β-碳上的官能團。近年來,通過開環(huán)反應(yīng)實現(xiàn)環(huán)烷烴衍生物解構(gòu)的方法已成為有機合成中極具吸引力的骨架躍遷策略。基于以上骨架躍遷策略,作者提出了一種通過"閉環(huán)-開環(huán)-閉環(huán)"策略實現(xiàn)的解構(gòu)性環(huán)丙烷化反應(yīng),該反應(yīng)能夠?qū)崿F(xiàn)官能團從一個碳骨架向烯烴α-或β-碳的遷移,從而達成環(huán)丙烷化合物的區(qū)域選擇性合成。具體過程如下:(1)烯烴首先通過[2+2]環(huán)加成反應(yīng)形成高張力環(huán)丁烷中間體,該張力為后續(xù)反應(yīng)提供驅(qū)動力;(2)環(huán)張力促使環(huán)丁烷發(fā)生開環(huán),在此過程中鍵的重排引發(fā)官能團遷移,并通過區(qū)域選擇性調(diào)控決定官能團遷移方向;(3)開環(huán)中間體經(jīng)由水介導的質(zhì)子穿梭過程進行親核取代,重新形成環(huán)狀結(jié)構(gòu),最終將官能團高區(qū)域選擇性地定位至烯烴的α或β位。值得注意的是,水分子在該過程中作為質(zhì)子轉(zhuǎn)移試劑,實現(xiàn)了對解構(gòu)中間體的質(zhì)子遷移(圖1)。
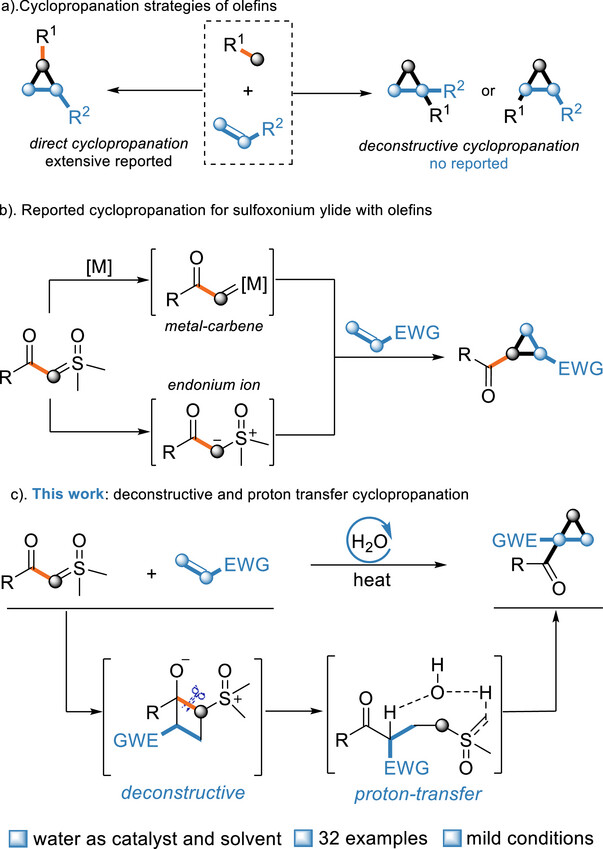
圖1. 烯烴的環(huán)丙烷化策略。
作者最初嘗試在DMSO溶劑中使用H2O,通過亞砜葉立德1a和烯烴2a實現(xiàn)了解構(gòu)性質(zhì)子轉(zhuǎn)移環(huán)丙烷化反應(yīng)。當反應(yīng)在100℃下進行12小時后,成功獲得了預(yù)期的1,1-二取代環(huán)丙基酮3a,產(chǎn)率為50%。基于這些結(jié)果,作者進一步優(yōu)化了反應(yīng)條件。增加水的用量顯著提高了產(chǎn)物產(chǎn)率。當使用DMSO/H2O(1:1)作為溶劑時,產(chǎn)物的產(chǎn)率達到78%。溶劑篩選實驗表明,DMSO/H2O(1:1)是最佳溶劑體系;相比之下,單獨使用H2O(0.5 mL)作為溶劑仍可獲得75%的產(chǎn)率。DMSO不僅能提高反應(yīng)溶劑的沸點,還能確保反應(yīng)體系的均相條件。值得注意的是,在沒有H2O存在的情況下無法獲得產(chǎn)物3a。通過條件優(yōu)化,確定最佳反應(yīng)溫度為100℃。將亞砜葉立德的用量增加至1.2當量并未提高產(chǎn)物的產(chǎn)率。當用CH3COOH或CH3CH2OH替代H2O時,目標產(chǎn)物的產(chǎn)率有所降低(Table 1)。

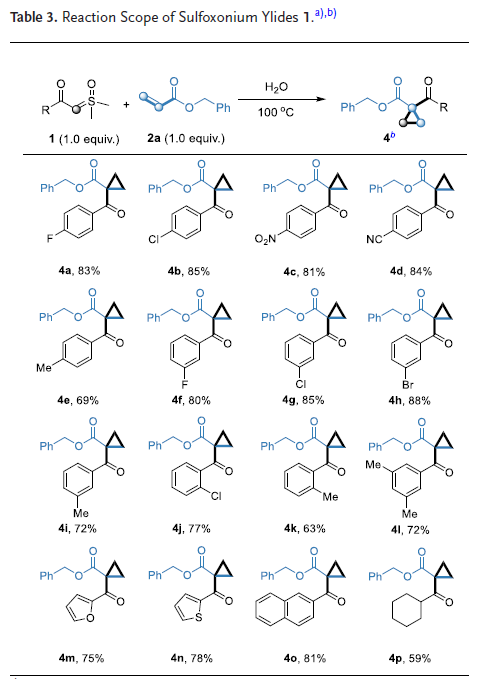
在優(yōu)化反應(yīng)條件下,作者系統(tǒng)考察了亞砜葉立德與缺電子烯烴的適用范圍。首先測試了一系列烯烴底物,發(fā)現(xiàn)該反應(yīng)對不同取代的丙烯酸酯均表現(xiàn)出良好的兼容性,相應(yīng)環(huán)丙烷產(chǎn)物的產(chǎn)率較高。通過研究取代基的電子效應(yīng)發(fā)現(xiàn)不同碳鏈長度的烷基取代基均能順利反應(yīng)并獲得良好產(chǎn)率,但含吸電子基團取代的苯環(huán)取代基的產(chǎn)率更高。值得關(guān)注的是,N,N-二甲基丙烯酰胺和3-氧代-3-苯基丙烯作為底物時也表現(xiàn)出良好的反應(yīng)性。進一步研究發(fā)現(xiàn),該反應(yīng)對非羰基取代的缺電子烯烴同樣適用:丙烯腈和苯基乙烯砜作為底物時,均能以可接受產(chǎn)率獲得目標產(chǎn)物。含額外烯烴基團和額外羰基的底物仍能得到目標產(chǎn)物。含活潑亞甲基的烯烴能選擇性地生成目標產(chǎn)物,且亞甲基未發(fā)生轉(zhuǎn)化。此外,含DL-薄荷醇和膽固醇結(jié)構(gòu)的烯烴也能以中等產(chǎn)率順利得到目標產(chǎn)物(Table 2)。

接下來,作者考察了多種亞砜葉立德的適用范圍。研究發(fā)現(xiàn),不同位置單取代的亞砜葉立德在最優(yōu)條件下均能順利反應(yīng)。無論是給電子基團還是吸電子基團取代的亞砜葉立德都具有良好的反應(yīng)性,能以中等至良好的產(chǎn)率轉(zhuǎn)化為目標環(huán)丙烷產(chǎn)物。值得注意的是,與給電子基團相比,吸電子基團取代的亞砜葉立德表現(xiàn)出更高的反應(yīng)產(chǎn)率。特別是硝基和氰基取代的亞砜葉立德同樣能以良好產(chǎn)率獲得環(huán)丙烷產(chǎn)物。呋喃、噻吩和萘取代的亞砜葉立德均表現(xiàn)出良好的兼容性。然而,烷基亞砜葉立德的反應(yīng)效果相對欠佳,僅以59%的產(chǎn)率得到相應(yīng)產(chǎn)物(Table 3)。
為探究反應(yīng)機理,作者進行了一系列控制實驗。首先進行了同位素標記實驗。亞砜葉立德1a在D2O中的核磁氫譜顯示,羰基α位C-H鍵發(fā)生了完全的D/H交換,證實了水相亞砜葉立德的可逆水合過程。在D2O/H2O(1:1)體系中觀測到1:2的D/H比例,表明反應(yīng)存在一級動力學同位素效應(yīng)。當改用D2O作為反應(yīng)溶劑時,得到氘代產(chǎn)物和氘代副產(chǎn)物。競爭性動力學同位素效應(yīng)實驗表明,水分子加成中間體時表現(xiàn)出正常的二級動力學同位素效應(yīng),并伴隨不可逆的sp3至sp2的雜化轉(zhuǎn)變。平行同位素實驗證實,水加成步驟并非催化循環(huán)的決速步。將模版反應(yīng)分別在H2O和D2O中反應(yīng)1小時后,混合物的核磁氫譜顯示亞砜葉立德的CH3基團發(fā)生顯著D/H交換。反應(yīng)過程監(jiān)測發(fā)現(xiàn)主產(chǎn)物3a的生成先于副產(chǎn)物3a',表明動力學上更傾向于形成主產(chǎn)物。值得注意的是,當用其他亞砜葉立德替代時反應(yīng)不能進行。同時,α位帶有取代基的亞砜葉立德和非末端烯烴均無法獲得目標產(chǎn)物(圖2)。

圖2. 機理研究。
基于上述實驗結(jié)果,作者提出了一種水分子催化的亞砜葉立德與烯烴發(fā)生解構(gòu)性質(zhì)子轉(zhuǎn)移環(huán)丙烷化反應(yīng)的可能機理。亞砜葉立德1a與苯丙烯酸酯2a 的Michael加成反應(yīng)生成中間體I。該中間體隨后對苯甲酰羰基進行分子內(nèi)親核進攻,形成兩性離子環(huán)丁烷中間體II。隨后,中間體II在醇鹽作用下發(fā)生環(huán)丁烷開環(huán),形成中間體III。反應(yīng)過程通過水介導的1,3-質(zhì)子轉(zhuǎn)移實現(xiàn)中間體III向中間體IV的轉(zhuǎn)變,隨后經(jīng)歷第二次質(zhì)子轉(zhuǎn)移生成中間體V。最終通過分子內(nèi)環(huán)化形成環(huán)丙基酮3a并釋放DMSO。水分子介導的質(zhì)子轉(zhuǎn)移促進了兩個羰基間碳負離子中間體的形成,這一關(guān)鍵步驟驅(qū)使反應(yīng)選擇性地進行環(huán)丙烷環(huán)合,而非通過羰基反應(yīng)性形成二氫呋喃衍生物。高分辨質(zhì)譜成功捕獲了不同的氘代中間體(圖3)。
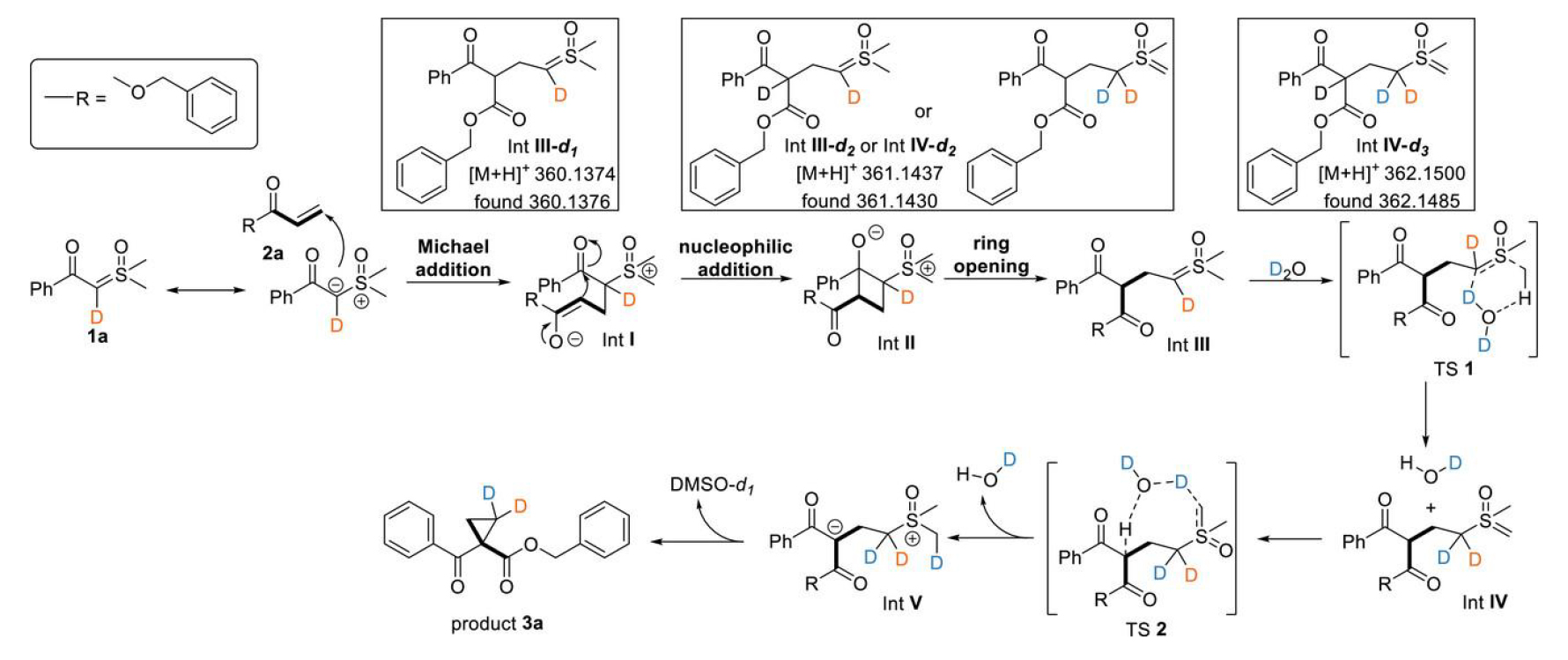
圖3. 反應(yīng)機理。
機理計算研究
為深入驗證所提出的反應(yīng)機理,作者進行了DFT計算。計算結(jié)果表明:水分子輔助形成環(huán)丁烷中間體的過程在能量上比直接生成環(huán)丙烷產(chǎn)物更為有利。該反應(yīng)以通過過渡態(tài)TS1的Michael加成作為決速步(活化能壘為20.8 kcal mol?1),隨后經(jīng)歷13.9 kcal mol?1的低能壘,完成苯甲酰羰基的分子內(nèi)親核加成,形成四元環(huán)中間體int3。值得注意的是,競爭路徑中通過傳統(tǒng)三元環(huán)過渡態(tài)TS2R生成副產(chǎn)物的能壘更高(16.8 kcal mol?1)。理論計算證實,環(huán)丁烷路徑的優(yōu)勢源于過渡態(tài)中更強的氫鍵相互作用——水分子與羰基氧的鍵距縮短至1.7 ?。特別重要的是,無水條件下環(huán)丁烷路徑的活化能(10.0 kcal mol?1)反而高于環(huán)丙烷路徑(8.4 kcal mol?1),導致選擇性反轉(zhuǎn)與傳統(tǒng)反應(yīng)結(jié)果一致。這些發(fā)現(xiàn)充分證明:氫鍵相互作用是調(diào)控該反應(yīng)選擇性的關(guān)鍵因素(圖4)。

圖4.含水(TS2R和TS-by)和不含水(TS2R-A和TS-by-A)的過渡態(tài)對比。
為進一步驗證該方法的合成應(yīng)用價值,作者實現(xiàn)了1-苯甲酰基環(huán)丙烷-1-甲腈的克級連續(xù)流動合成。為充分展示產(chǎn)物的衍生化潛力,作者以了1-苯甲酰基環(huán)丙烷-1-甲腈為底物開展了系列轉(zhuǎn)化實驗:(1)通過有機催化Cloke-Wilson重排反應(yīng)轉(zhuǎn)化為2,3-二氫呋喃衍生物;(2)采用NaBH4選擇性還原獲得β-羥基腈;(3)醇解反應(yīng)得到酯類環(huán)丙基酮;(4)水解反應(yīng)制備羧酸。所有轉(zhuǎn)化均順利進行,充分證明了本方法產(chǎn)物的合成應(yīng)用價值(圖5)。

圖5. 克級連續(xù)流動合成與官能團化研究。
總結(jié)
在這項工作中,作者成功開發(fā)了一種水催化亞砜葉立德與烯烴的解構(gòu)性質(zhì)子轉(zhuǎn)移環(huán)丙烷化反應(yīng)。該反應(yīng)以亞砜葉立德和烯烴為起始原料,在溫和條件下高效構(gòu)建1,1-二取代環(huán)丙基酮類化合物。通過控制實驗和DFT計算研究,成功闡明了水分子參與質(zhì)子轉(zhuǎn)移的反應(yīng)機理。值得注意的是,該方法可適用于連續(xù)流動合成,為工業(yè)化應(yīng)用提供了重要途徑。
這一研究成果發(fā)表在Advanced Science,云南大學藥學院的于祥林博士為該論文的第一作者,云南大學藥學院的金毅研究員和哈爾濱工業(yè)大學(深圳校區(qū))理學院的宋麗娟教授為共同通訊作者。該工作得到了國家自然科學基金,云南省自然科學基礎(chǔ)項目基金,廣東省自然科學基金等基金的支持。
聲明:化學加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn