

Peganumine A是2014年分離得到的一個二聚四氫-β-咔啉生物堿。其具有非常新穎、較為復雜的八環結構,其中核心結構為3,9-二氮四環[6.5.2.01,9. 03,8]十五-2-酮結構單元。它同時還展現出對MCF-7,PC-3,HepG2細胞很好的細胞毒活性,并對HL-60有選擇性影響(IC50 = 5.8 μM)。但其極低的分離產率為進一步的生物活性研究帶來了困難。從其生源合成來看,Peganumine A極有可能是由色胺衍生的兩個C1取代的β-咔啉A和B通過螺環化及后續的內酰胺化得到(如圖一)。盡管這種生源轉化不無可能,但是在實驗室中實現這種[3+2]雜螺環化過程卻有一定的困難。
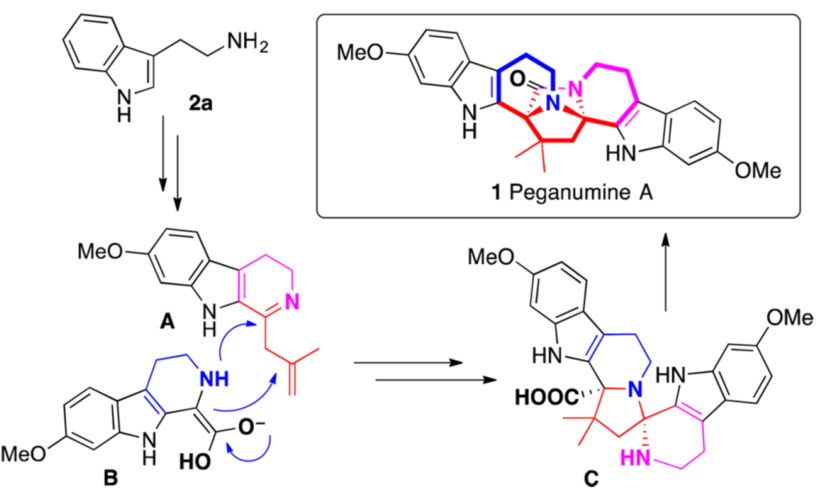
圖一 Peganumine A 及其可能的生源合成
就Peganumine A的化學合成而言,核心工作是對四環結構D的合成。因為該結構的構筑將實現兩個四氫-β-咔啉的連接,從而搭建起2,7-二氮雙環[2.2.1]庚-3-酮核心單元。同時,Peganumine A中的兩個立體季碳中心也在此結構上。因而作者提出了圖二所示反合成分析。D中醛縮胺結構可以由E中仲胺對N-酰基亞胺鹽加成得到。而E又與烯胺F互為平衡。進一步反合成分析可知,F可以由帶有親核位點的胺G和α-酮酰胺H縮合得到。這樣的反合成后,作者認為可以通過“一鍋”的串聯反應操作由G和H直接合成D。在此過程中,Ca處通過Pictet-Spengler反應建立的立體化學,將會完全傳導至Cb處,進而建立起Peganumine A中的兩個季碳立體中心。
因此,通過催化不對稱Pictet-Spengler反應將會使潛手性合成砌塊G和H轉化為光學純的目標化合物D。化合物H可以由δ-氧代-α-酮內酰胺I通過跨環環化而成。最后化合物I可以由線性ω-氨基-δ-氧代-α-酮酸J通過傳統的策略制備(a斷裂方式)。但是作者在此處也提出了由ω-異腈基-γ-氧代醛K通過分子內Passerini反應或Ugi反應制備I的策略(b斷裂方式)。這樣的逆推策略較為少見,因而它也為探索異腈在合成化學中的應用提供了新的機遇。
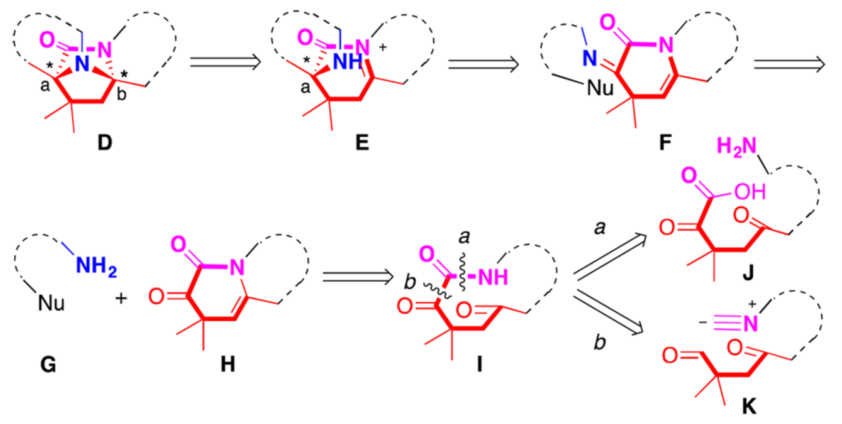
圖二 peganumine A核心結構的反合成分析
作者具體的合成過程如下:首先是不同色胺衍生物的制備(如圖三)。作者先從化合物3出發,將其轉化成三氟甲酸混酐后,在苯硫酚的作用下制備得到苯硫酚酯4。再將產物4進行臭氧化得到醛5。同時,作者也選擇了色胺作為模板反應。他們先將色胺在甲酸乙脂作用下甲酰化,然后用Boc保護吲哚環上的活性氮。隨后使用原位制備的四甲基哌啶鋰實現吲哚環2-位的鋰化。此類烯基鋰化物與三丁基錫氯交換得到錫化物7a。
至此,作者已經制備得到了Liebeskind-Srogl交叉偶聯的前體化合物,但是在經典的Liebeskind-Srogl交叉偶聯條件下7a和5卻并未發生偶聯。于是通過系統的條件篩選,作者最后發現使用Pd2dba3,CuDPP,AsPh3條件就可順利得到理想的偶聯產物8a。
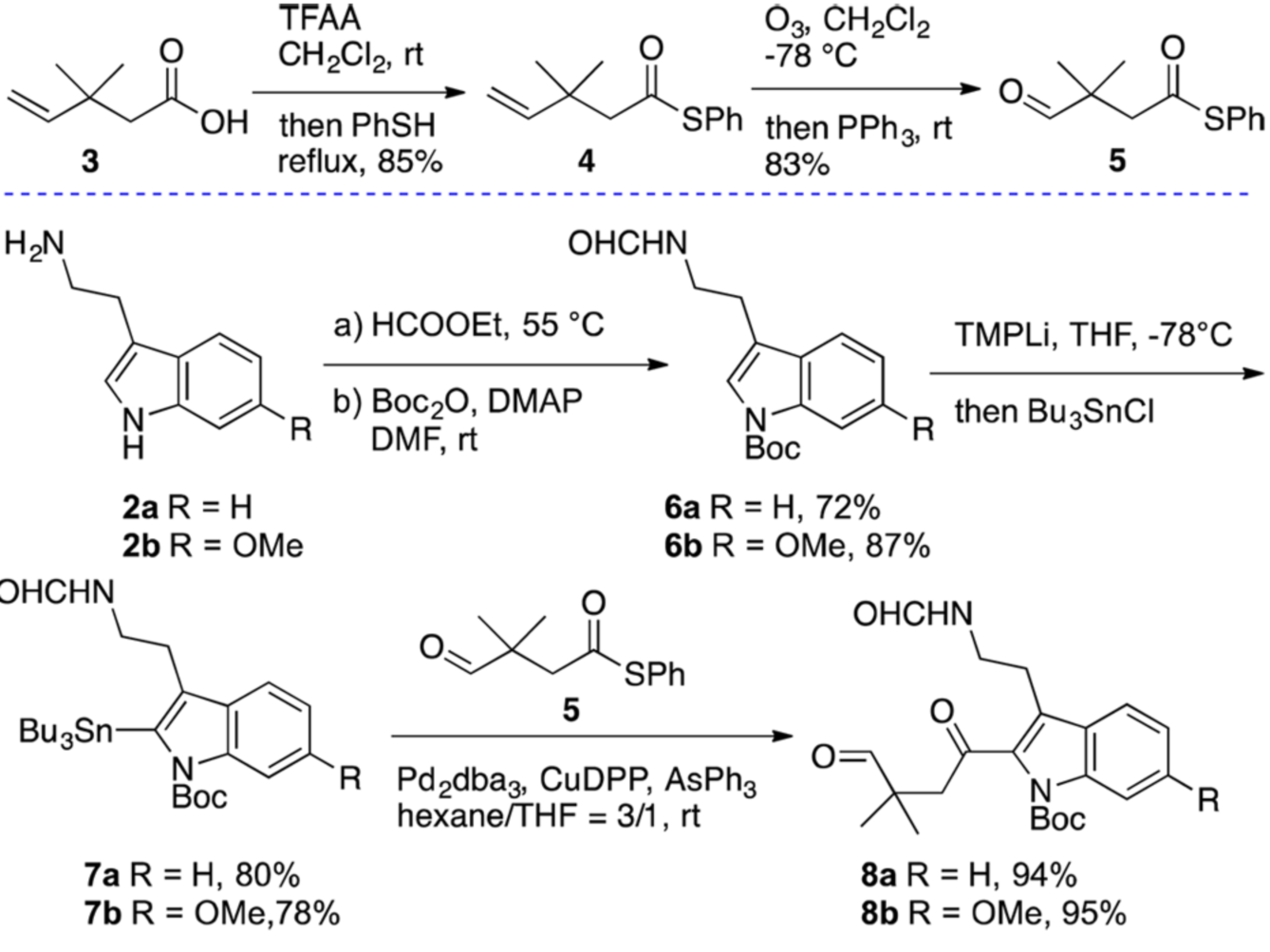 圖三 C2酰基化的色胺衍生物的合成
圖三 C2酰基化的色胺衍生物的合成
得到8a后,在POCl3作用下先對其脫水制備得到b斷裂策略所設計的異腈9a。隨后9a在三氟乙酸促進下發生Passerini 3-中心-2-組分的串聯反應直接得到四環中間體10a。再利用Corey-Kim氧化就能將10a有效的氧化得到α-酮酰胺13a(如圖四)。在順利的實現了模板反應后,作者又從6-甲氧基色胺2b出發,利用相同的合成過程實現了α-酮酰胺13b的合成(如圖三和圖四)。
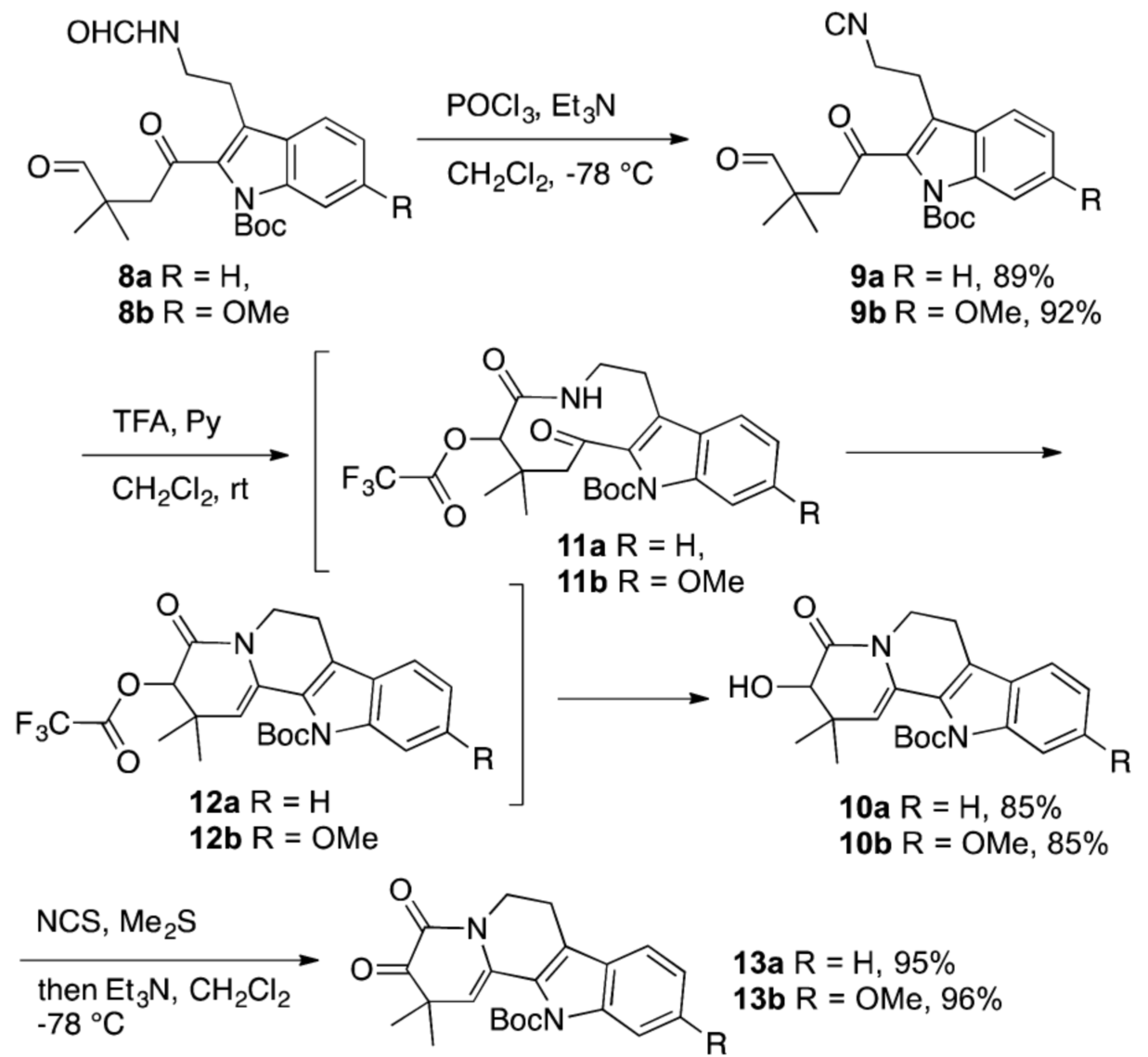
圖四 通過Passerini 3-中心-2-組分反應合成四環α-酮酰胺13
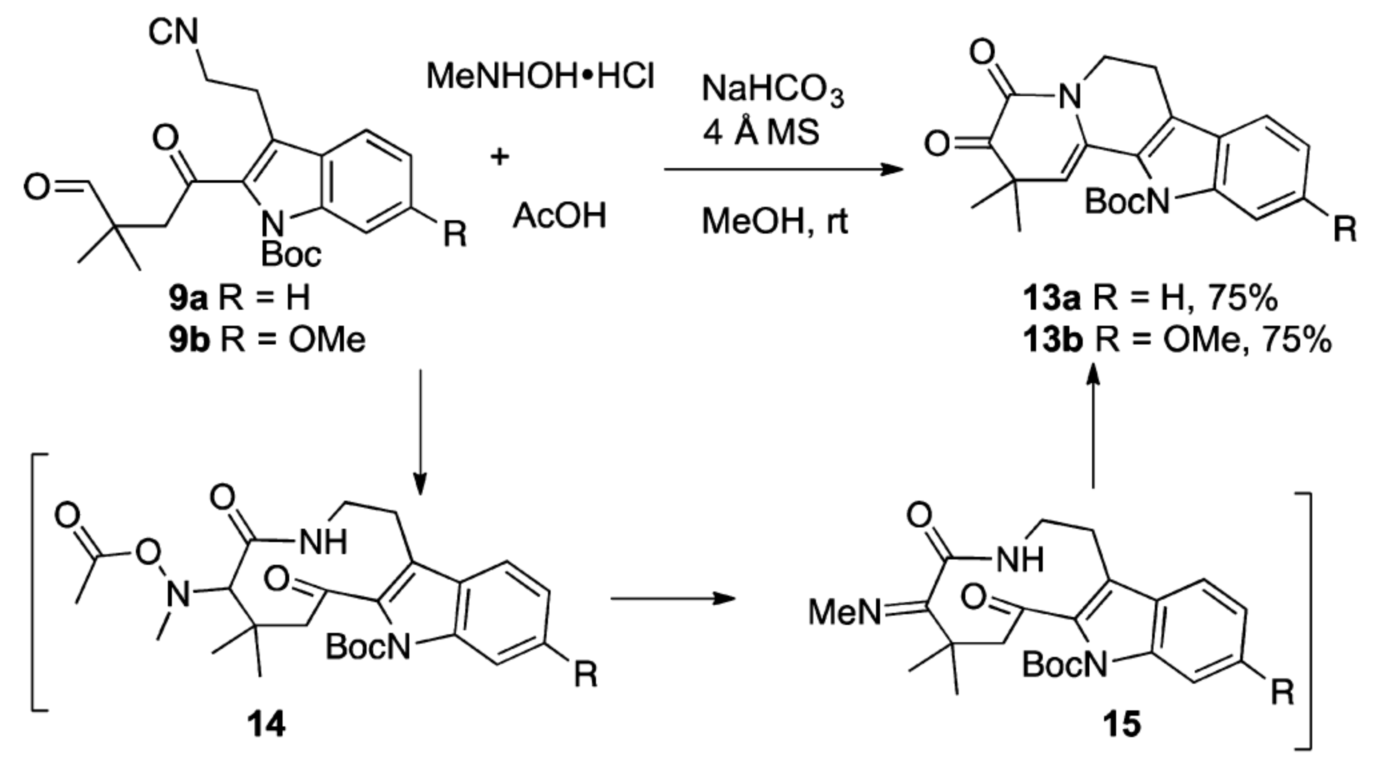 圖五 從異腈9“一鍋”制備四環α-酮酰胺13
圖五 從異腈9“一鍋”制備四環α-酮酰胺13
在成功利用Passerini 3-中心-2組分反應制備化合物13基礎上,作者又利用Uig 4-中心-3-組分的策略,通過一個氧化還原過程從異腈9出發,更為高效的合成了化合物13(如圖五)。接下來作者嘗試了色胺2b和四環α-酮酰胺13的縮合,TFA催化的Pictet-Spengler及串聯的環化、脫保護反應。通過實驗,作者分別順利的得到Peganumine A及(±)-9’- demethoxy-Peganumine A(如圖六)。
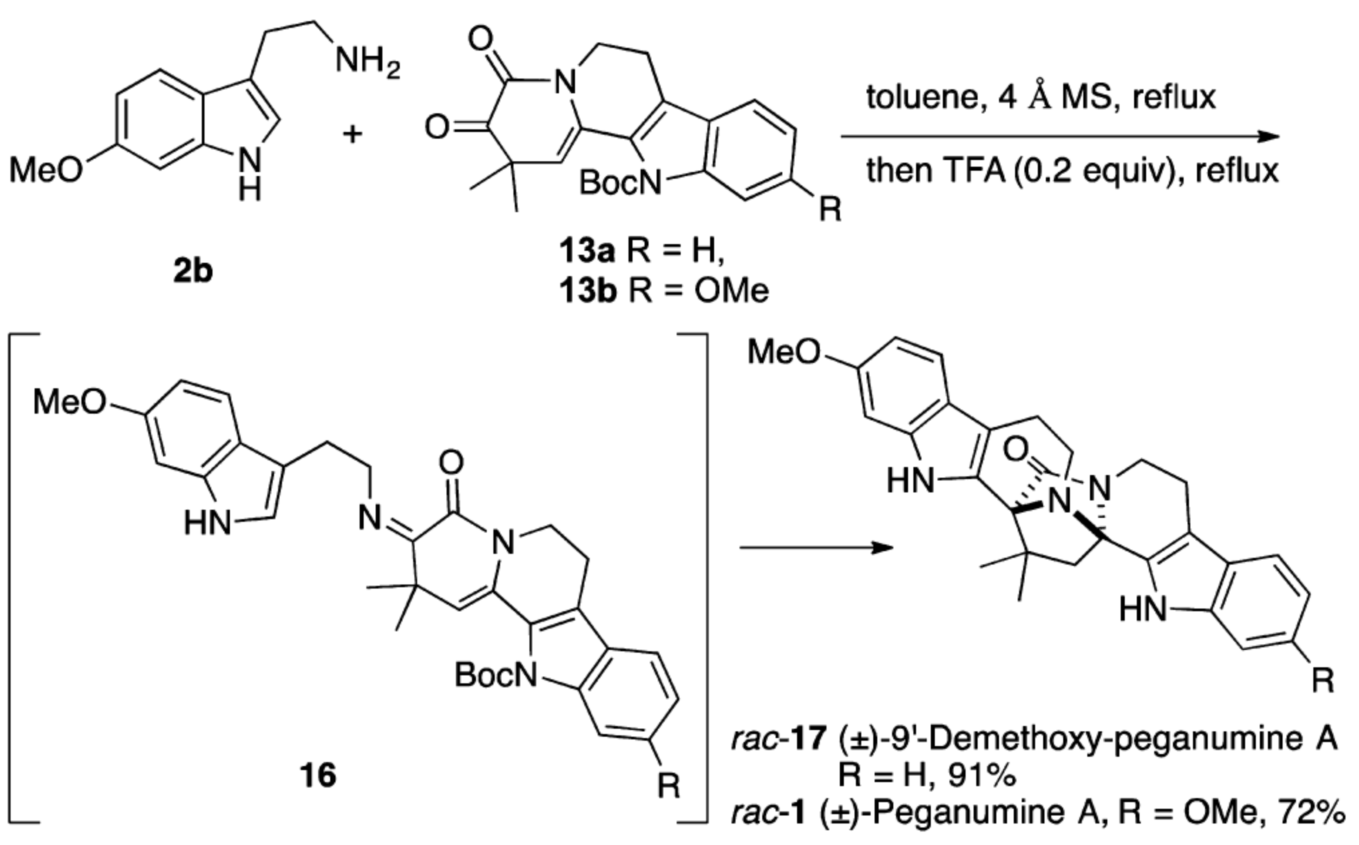 圖六 (±)-Peganumine A 及其類似物的合成
圖六 (±)-Peganumine A 及其類似物的合成
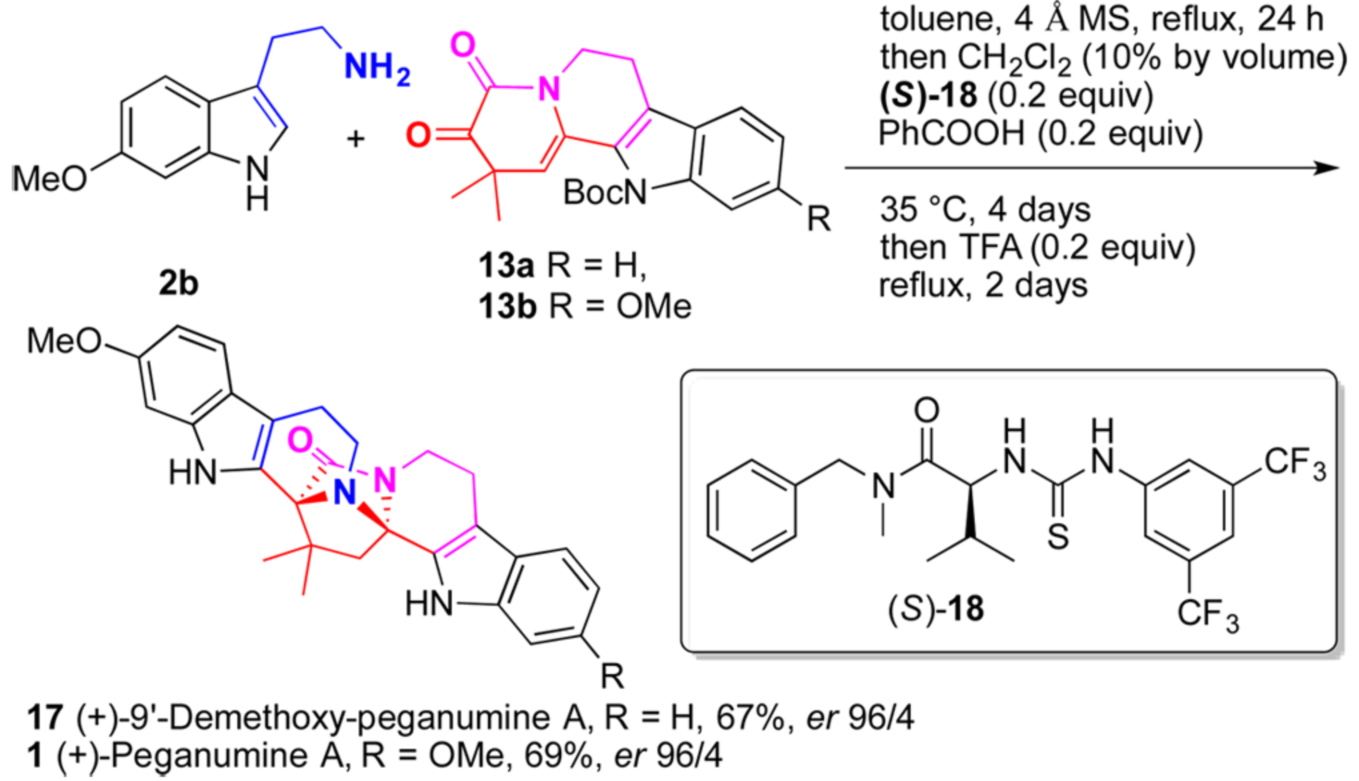
圖七 硫脲催化下對映選擇性合成(+)-Peganumine A
通過以上合成過程作者已經順利的實現了其起初設計的絕大多數策略,所欠缺的是手性中心的構筑。在上述工作的基礎上,利用手性酸實現不對稱的合成應是水到渠成。但是當作者使用手性磷酸TRIP去催化2b和13a的反應時卻只得到產率與ee值極低的9’-demethoxy-Peganumine A。隨后,作者計劃使用Jacobsen’s手性硫脲進行嘗試。盡管該類手性硫脲還沒有被用于不對稱的Pictet-Spengler反應,但是作者還是選擇了該催化劑進行嘗試。經過了系統的條件篩選后,作者最終順利的實現了Jacobsen’s 手性硫脲(S)-18和苯甲酸催化下2b與13的偶聯及不對稱的Pictet-Spengler反應。接著“一鍋法”在三氟乙酸催化下發生串聯的跨環環化和脫保護過程,最終實現了對(+)-9’-demethoxy-Peganumine A 和(+)-Peganumine A的全合成。
該串聯過程以較好的產率及高對映選擇性得到了(+)-9’-demethoxy-Peganumine A 和(+)-Peganumine A(如圖七)。最后,作者也嘗試了克級規模的制備,也以相當的產率及對映選擇性得到了相應的目標化合物。
總結
祝介平課題組設計了一條高效、簡潔的合成路線,實現了對(+)-Peganumine A的不對稱全合成。該合成過程線性最長步驟為7步,總產率達到33%,ee值高達92%。整個合成過程兩個亮點為:利用Uig 4-中心-3組分氧化偶聯高效制備四環α-酮酰胺中間體;手性硫脲與苯甲酸共同催化下實現潛手性底物的偶聯及不對稱Pictet-Spengler反應,同時“一鍋法”條件下串聯的三氟乙酸催化的跨環環化及脫保護完成Peganumine A的合成。克級規模的制備也為該化合物及類似物后續的構效關系研究提供了充足的樣品。該合成過程中作者熟練的應用多組分反應及串聯反應,為高效、簡潔的進行天然產物全合成提供了很好的范例。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn