

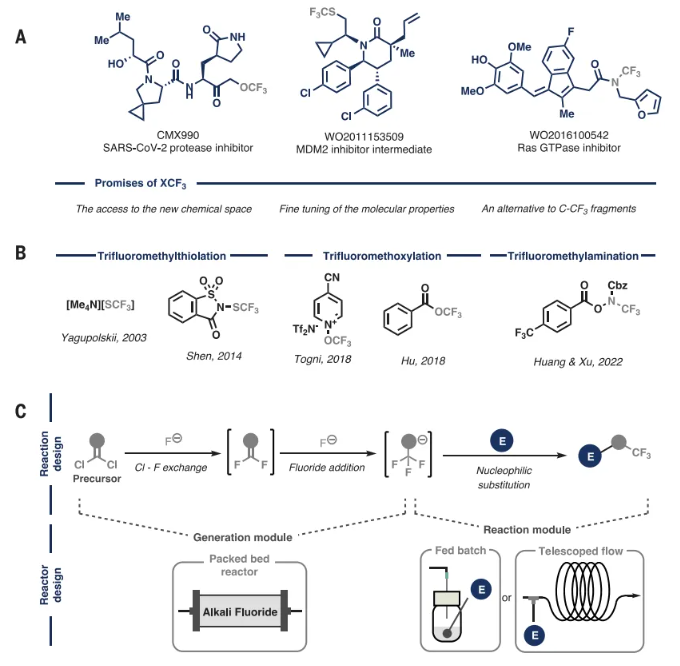
圖1. 研究背景(圖片來源:Science)
最近,人們對加入與雜原子相連的三氟甲基的興趣日益濃厚,如三氟甲氧基(OCF3)、三氟甲硫基(SCF3)和N-三氟甲基(NCF3)(圖1A)。這些新興的氟化單元進一步調節親脂性、抗氧化性和酸堿性。盡管這些片段很有吸引力,但它們在API中的代表性卻遠遠不足,占總含CF3藥物的不到10%。主要障礙在于缺乏將它們整合到分子骨架中的合成方法(圖1B)。此外,這些定制試劑的制備通常涉及多個步驟的繁瑣過程,從而產生大量氟化廢物。因此,開發在合成后期從簡單的非氟化有機分子合成這些單元的方法至關重要。理想情況下,這將涉及使用廉價且廣泛可用的堿性氟化物源,以避免進一步污染。化學加——合成化學產業資源聚合服務平臺。
本文的策略旨在開發一種多功能方案,該方案能夠按需生成N-、S-和O-CF3陰離子并促進它們立即用作親核試劑(圖1C,反應設計)。該策略需要使用堿性氟化物鹽作為氟源,結合每個單元的適當前體來制備三氟甲基雜原子陰離子。前體應(i)實驗臺穩定,(ii)可商購或易于制備,(iii)具有高原子經濟性。從概念上講,作者設想的機制涉及通過兩個連續的氯-氟交換反應從這些前體中順序制備三氟甲基,最終添加氟化物以產生所需的親核試劑。然后,這些活性物種將立即與合適的親電試劑反應以形成新的C-N、C-S或C-O鍵。
作者基于之前對氯化硫中氯氟交換的研究,決定利用流動化學技術進行這些轉化(圖1C,反應器設計)。由于表面積增加,有機中間體與不溶性氟化物鹽之間的混合得到改善,這種設計提高了多次氟化物添加的效率。這種方法提供了更高的安全性,因為所有形成的中間體都包含在微流體系統中。此外,通過在CF3X陰離子發生器下游集成一個反應模塊,實現了陰離子與親電試劑的無縫反應,為帶有雜原子-CF3單元的分子衍生化提供了一個發散且精簡的平臺。
研究始于引入NCF3片段。作者推斷受保護的亞胺基二氯(圖2,1-3)可作為合適的前體,通過與氟源反應生成NCF3(PG)陰離子,從而通過三個連續的碳氟鍵形成獲得親核物種。這些前體可以從廉價且易得的起始原料中獲得,以克為單位,帶有不同的保護基(Ts 1 >30 g、Cbz 2 >4 g、Boc 3 7 g)。此外,15N標記的亞胺基二氯也很容易合成[(15N)Ts 1 >3 g],從而可以獲得同位素標記的含15NCF3的產品。由于試劑1是固體,而試劑2和3是液體,因此它們與光氣的結構相似性引起的安全問題在一定程度上因其物理狀態而得到緩解。此外,1具有良好的熱穩定性,僅在溫度高于180 °C時才會發生分解。
初步批量實驗表明,將對甲苯磺酰基保護的亞胺基二氯1與9當量的氟化銫(CsF) 在乙腈中混合后,2小時后即可通過19F NMR觀察到目標三氟甲氨基陰離子物種。隨后將芐基溴添加到粗反應混合物中,在80 °C下反應2小時后,以63%的產物得到三氟甲基胺4。

圖2. 按需生成NCF3(PG)陰離子及其與親電試劑的反應(圖片來源:Science)
接下來,將這種方法轉變為作者設計的流動系統。為了在保持最佳親核性的同時緩解α-脫氟化,將18-冠-6與本文的前體結合使用。這種方法使銫陽離子能夠絡合,防止它們與氟原子相互作用并穩定所需的陰離子種類。因此,將亞胺基二氯1和18-冠-6 (1當量)的溶液流過裝有CsF的墨盒,可將NCF3(Ts)陰離子的生成加速至僅7分鐘。
在確認了模塊化的良好結果后,繼續通過離去基團評估來評估陰離子物種的反應性(圖2,離去基團評估)。結果表明,需要有效的離核劑才能使反應順利進行。對于芐基基準底物,氯化物、乙酸酯、三氟乙酸酯和Katritzky鹽親電試劑未能產生所需產物。而溴化物、碘化物、甲磺酸酯和對甲苯磺酸酯衍生物是形成產物4的合適底物,產率59%- 98%。對于正己基底物,含碘底物在三氟甲磺酸銀存在下發生了令人滿意的取代,從而形成了烷基胺 5,而溴化物、甲磺酸酯和對甲苯磺酸酯類似物仍然提供了適合藥物化學應用的目標產物。
隨后,作者著手研究生成的NCF3(Ts)陰離子與不同官能團的兼容性(圖2,官能團兼容性)。具有鹵素取代基和強吸電子基團(如三氟甲基、腈和硝基)的衍生物以良好的產率高效地轉化為相應的產物。羰基衍生的官能團(如醛、苯基酮和甲酯)也與三氟甲基胺化反應在很大程度上兼容。盡管具有質子性質,但游離羧酸的存在也是可以容忍的。此外,硼酸頻哪酯取代的芳烴反應產率在合成上是有用的,而乙烯基和乙炔衍生物反應產率較高。最后,三甲基硅基、甲氧基和硫代甲氧基等電子給體取代基是兼容的,可以以良好至極好的產率生成取代的三氟甲基胺。
接下來,作者探索了三氟甲基胺化方案與各種親電試劑的兼容性。NCF3片段帶有不同的保護基,在80 °C下僅用2小時就成功安裝在芐基和烯丙基結構單元中。本文的方法與從15N標記的前體開始直接引入同位素標記的 15NCF3(PG)片段進一步兼容。對于這種轉化,陰離子的生成和取代步驟都是批量進行的,突出了該方法的通用性。接下來,一級和二級烷基碘化物都經歷了有效的三氟甲基胺化,還以中等至良好的產率獲得了含氮雜環和乙酰基保護的半乳糖基溴化物。最后,作者將此方案應用于各種API中間體,包括源自密集功能化的替格瑞洛、氯那唑酸類似物、匹伐他汀和烏米非韋的中間體,證明了與復雜分子結構的兼容性以及不同N保護基團的結合。
在NCF3(PG)陰離子生成流動系統取得成功的基礎上,作者繼續研究如何按照按需生成策略加入基于硫屬元素的三氟甲基片段。對于三氟甲硫基陰離子[(SCF3)-]的按需流動生成,選硫光氣41為前體。對于三氟甲氧基陰離子[(OCF3)-],選擇雙光氣42作為前體。與受保護的亞胺基二氯化物的過程類似,與氟化銫和選擇的前體的反應最初會分別產生氣態硫羰基或碳酰氟中間體。然而,封閉的流動系統確保這些中間體迅速與另一個氟離子發生進一步反應,從而快速完全形成所需的三氟甲基硫屬元素陰離子,從而減輕任何潛在的安全風險。經過短暫的優化,三氟甲硫醇陰離子的停留時間最短為5分鐘,三氟甲氧基陰離子的停留時間最短為7分鐘。有了這些結果,作者開始評估各種親電配偶體。
SCF3片段可成功整合到一級(圖3)和二級烷基親電試劑中,以良好至極好的產率(高達94%)提供天然產物衍生物,如SCF3修飾的蛋氨酸、膽固醇和雄酮。與芐基和烯丙基底物(包括塞來昔布衍生物)的親核取代反應產生了產率極高的三氟甲硫基化產物。這些轉化可以以疊層流動的方式高效進行,從而將反應時間從2小時縮短到僅5分鐘,同時保持幾乎相同的產率。生成的陰離子也經過芳香親核取代反應,生成Csp2-SCF3產物,以及親核酰基取代反應,形成所需的硫酯。
在本文的親核三氟甲氧基化方案中,二級烷基溴化物以良好的產率迅速轉化為相應的產物。該反應是多功能的,可以為具有多個官能團和雜環骨架的烯丙基和芐基底物提供良好至優異的產率的產品,還適用于API中間體衍生物,如塞來昔布、匹伐他汀、烏米芬諾韋和洛那唑酸類似物。此外,三氟甲氧基陰離子也可發生SNAr型反應,且可以修飾糖基底物。

圖3. 按需生成SCF3和OCF3陰離子及其與親電試劑的反應(圖片來源:Science)
此外,本文的方法可以擴展到包含更長的多氟乙氧基鏈。通過使氟烷基酸酐作為陰離子前體流過CsF填充床,這些底物可以首先經歷酰氟形成,然后在第二次添加氟化物時形成烷氧基陰離子。利用這種策略獲得了四氟乙氧基和五氟乙氧基衍生的糖基產物。
總結
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn