

P-手性有機膦氧化合物,含有一個或兩個C-P鍵,是一類具有重要價值的結構,在藥物化學和有機合成中具有廣泛應用。這些手性P(V)化合物廣泛存在于許多天然產物、藥物和生物活性分子中。在含有一個C-P鍵的化合物中,替諾福韋艾拉酚胺是治療慢性乙型肝炎的一線藥物;含有兩個C-P鍵的化合物也可由其單C-P鍵對應物衍生而來,展現出多樣化的生物活性。例如,Phostine表現出有效的抗增殖特性(圖1)。
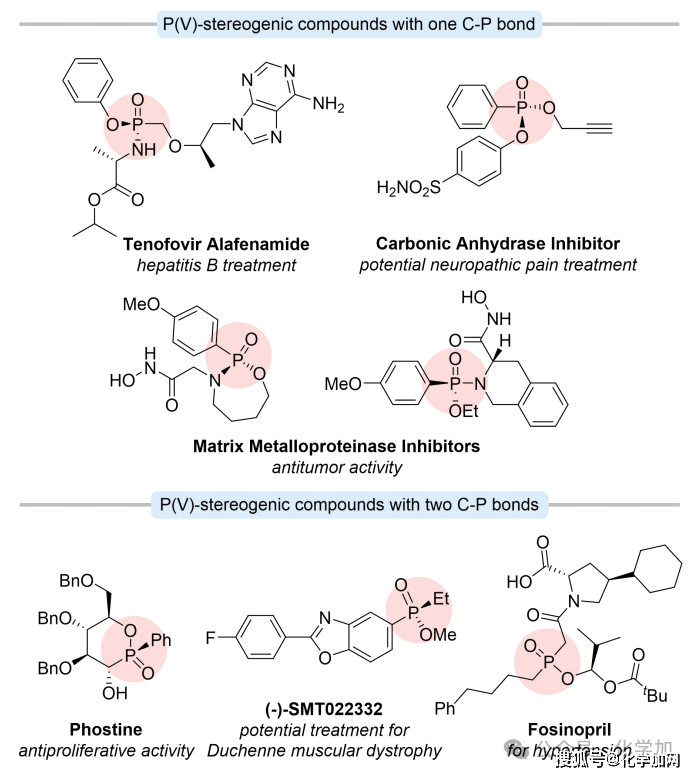
圖1 含有C-P鍵的膦氧化物的重要性
由于其立體構型對活性具有重要影響,因此發展高效、高選擇性合成P-手性中心的方法成為該領域的關鍵挑戰。傳統合成路徑主要依賴外消旋體拆分與手性輔助基誘導策略,前者受限于50%的理論產率上限,后者則需引入并后續移除手性導向基團,步驟繁瑣且原子經濟性低。相比之下,不對稱催化能夠直接構筑P-手性中心,具有步驟簡潔的優勢,是當前該領域的研究重點。近年來,催化不對稱去對稱化策略在構建含C-P鍵的P(V)手性分子方面取得重要進展(圖2A),Jacobsen團隊(Science2022, 376, 1230?1236)、Dixon、Yamazaki(Nat. Chem.2023, 15, 714?721; Angew. Chem. Int. Ed. 2024, 63, e202400673)和Chi(Chem 2025, 11, 102586)等課題組先后開發了基于氫鍵給體、超強堿雙功能氨基磷烷及N?雜環卡賓等催化體系,為P?手性化合物的合成開辟了新途徑。這些工作與李光勛(J. Am. Chem. Soc. 2025, 147, 11010?11018)、何智濤(J. Am. Chem. Soc. 2025, 147, 13566?13576)、Dong (J. Am. Chem. Soc. 2025, 147, 21339?21346)及商明 (Angew. Chem. Int. Ed. 2025, 64, e202509807)等課題組的全雜原子取代的磷(V)手性中心的研究共同推動了該領域發展。另一方面,催化不對稱磷酰化也是構建P-手性中心的重要策略(圖2B)。然而,現有含C-P鍵手性膦氧化合物的不對稱合成方法,在催化劑可獲得性、反應普適性與對映選擇性方面仍存在不足,亟需發展更為高效、通用且催化劑易于制備的新型催化體系。自2010年始,上海交通大學張萬斌課題組基于“鍵角調控”策略開發了一系列具有雙環咪唑結構的有機小分子催化劑。利用該類催化劑,他們報道了首例構建磷(V)手性的不對稱磷酰化反應,并成功地實現了磷(V)手性抗新冠藥物瑞德西韋的高效不對稱合成(J. Am. Chem. Soc. 2010, 132, 15939-15941; Tetrahedron: Asymmetry 2012, 23, 329?332; Chem. Commun.2017, 53, 1381-1384; Angew. Chem. Int. Ed. 2020, 59, 20814-20819; Angew. Chem. Int. Ed. 2021, 60, 1641-1645; CCS Chem. 2023, 5, 361-371; ACS Catal. 2023, 13, 16300-16306)。基于此,最近該團隊報道了一種手性雙環咪唑雙功能手性催化劑,能經由膦酰二氯去對稱化及后續的立體專一性SN2親核取代過程,從而一鍋法地實現多種結構的手性膦氧化合物的合成(圖2C)。該方法可以高效制備系列含有P-O/P-S/P-N鍵結構的P(V)-手性分子,且收率與對映選擇性表現優異。此外,所得產物還可以進一步被醇解,生成的手性膦酸酯又可以多樣化精準衍生,構筑新的P-S/P-C/P-C(Ar)鍵,為合成具有生物活性的高價值手性膦氧化合物提供了通用平臺。
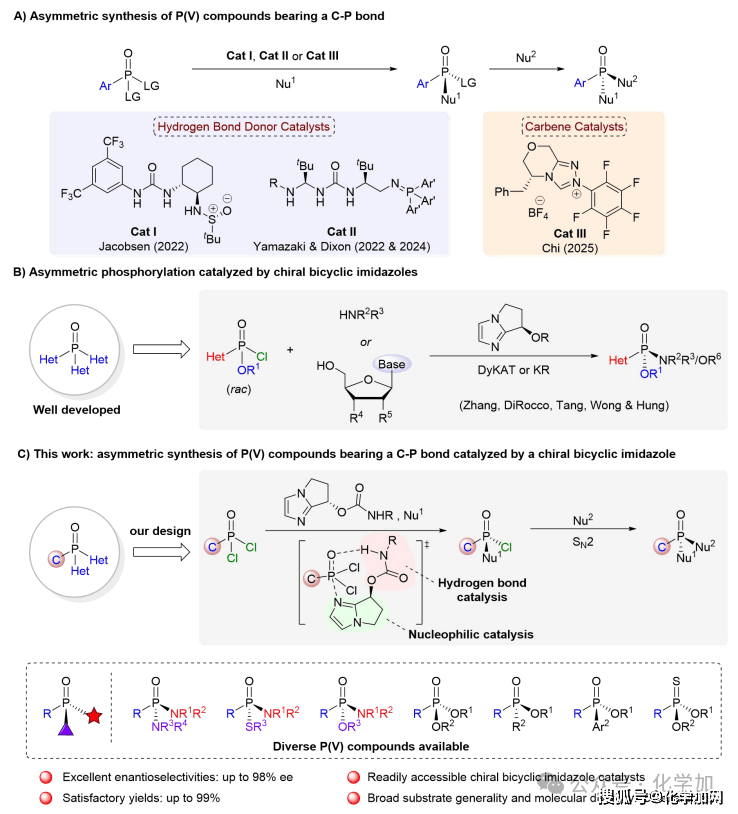
圖2A通過去對稱化策略構建含C–P鍵的P(V)立體中心.2B雙環咪唑催化不對稱磷酰化反應.2C本工作:雙環咪唑催化一鍋構建手性劑對手性磷(V)立體中心
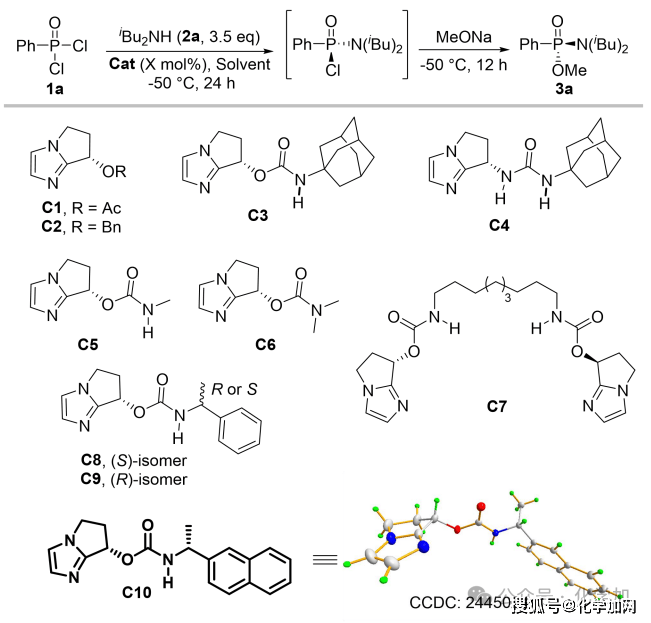
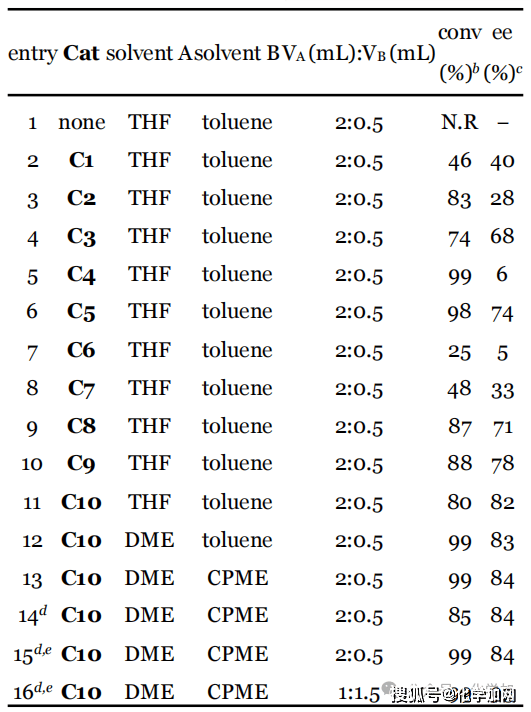
圖 3 部分條件優化
作者首先以市售的苯基膦酰二氯為模板底物,二異丁胺作親核試劑與縛酸劑,并以四氫呋喃和甲苯分別作反應溶劑與底物溶劑,在-50 °C的低溫條件下對催化劑進行了篩選和優化。實驗結果表明,不添加催化劑時,反應無法進行。C1和C2催化劑在不對稱C-酰化反應中展露出較好的效果,但在此條件下,該催化劑的立體控制效果有限(entry 2-3)。基于C3在瑞德西韋的不對稱合成中的優異表現,研究團隊嘗試其催化該反應,獲得74%轉化率和68% ee(entry 4)。進一步結構修飾發現:將C3的氨基甲酸酯結構片段換為脲基(C4)可提高反應活性但損害對映選擇性(entry 5);N–H鍵對高催化性能至關重要(C5/C6,entry 6-7)。隨后篩選多種NH-取代催化劑,確定了最優催化劑C10表現出最高立體選擇性(82% ee,entry 11)。隨后進行溶劑以及反應時間等條件的優化,最終確定以1 mL DME為反應溶劑,1.5 mL CPME溶解底物,催化劑負載降至15 mol%,第一步反應36小時,隨后使用甲醇鈉淬滅可在高轉化率下保持高對映選擇性(entry 16)。
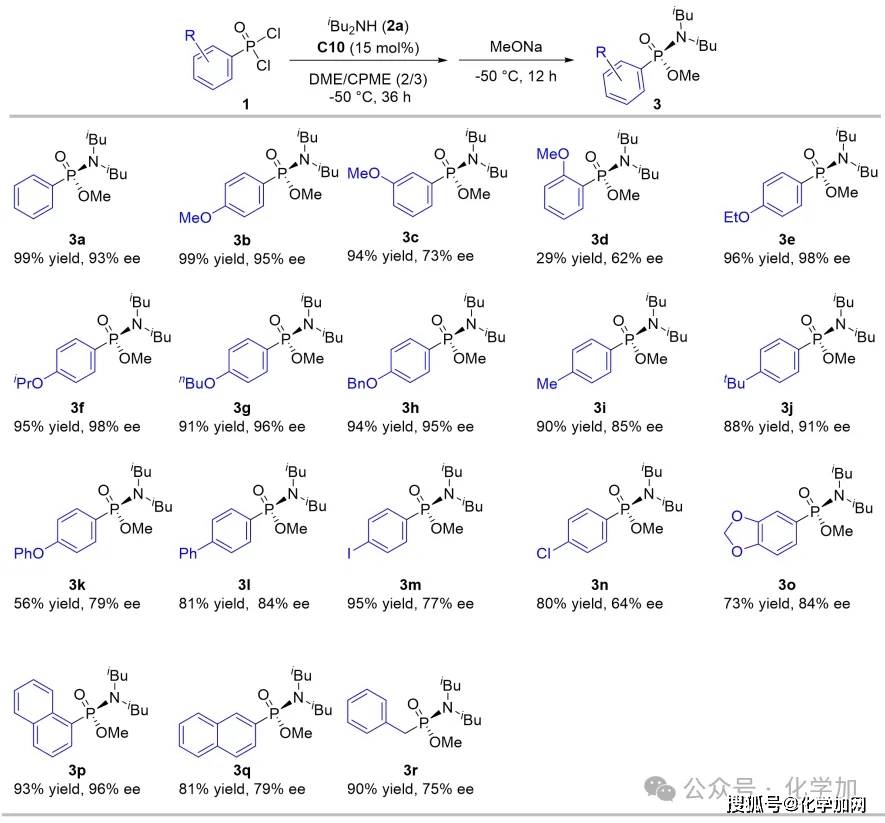
圖4 底物膦酰二氯篩選
此后,作者系統考察了該催化體系對各類膦酰二氯底物的兼容性。研究發現苯環為對位帶烷氧基的底物普遍能以高收率和高對映選擇性獲得目標產物(3b, 3e-3h);間位甲氧基取代底物延長反應時間至48小時后,產率為94%但選擇性降低至73%(3c);而鄰位取代底物則因空間位阻大、溶解性差,導致反應性明顯下降(3d)。然而,當引入吸電子基團,反應的對映選擇性會出現顯著降低,延長第一步的反應時間至48小時,可以提高反應產率。該反應對二取代苯環底物(3o-3q)同樣適用,并能兼容烷基膦酰二氯,例如芐基底物能以90%的產率和75%的ee值得到產物(3r)。這些結果一致表明,芳環上對位給電子取代基有助于提升磷中心的電子云密度,從而穩定催化中間體,實現更好的催化效果。作者還分離純化了產物(3b)的前體化合物氯代膦酰胺,該化合物的對映選擇性為96%。
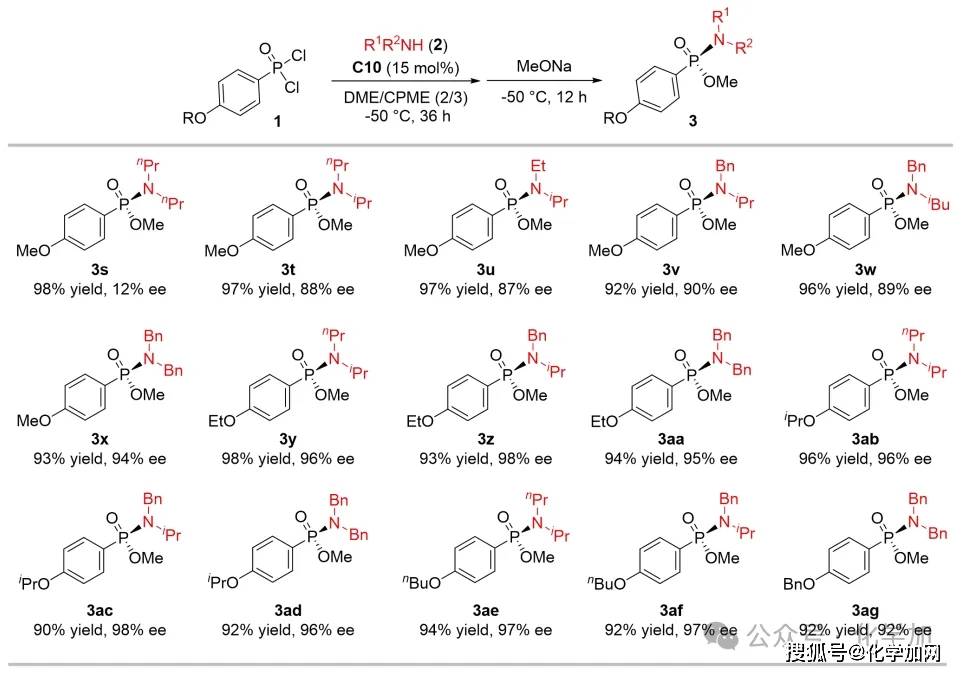
圖5 二級胺篩選
作者選用對甲氧基苯基膦酰二氯作為模型底物(1b),系統考察了不同結構二級胺的反應性能。鑒于二級胺在該轉化中兼具親核試劑和縛酸劑的雙重功能,研究人員特別關注了胺類試劑的親核性與堿性的平衡關系。實驗結果表明,篩選獲得的優勢二級胺與苯環對位為其它烷氧基取代的苯基膦酰二氯底物反應,催化產物仍能保持優良的收率與出色的對映選擇性控制。
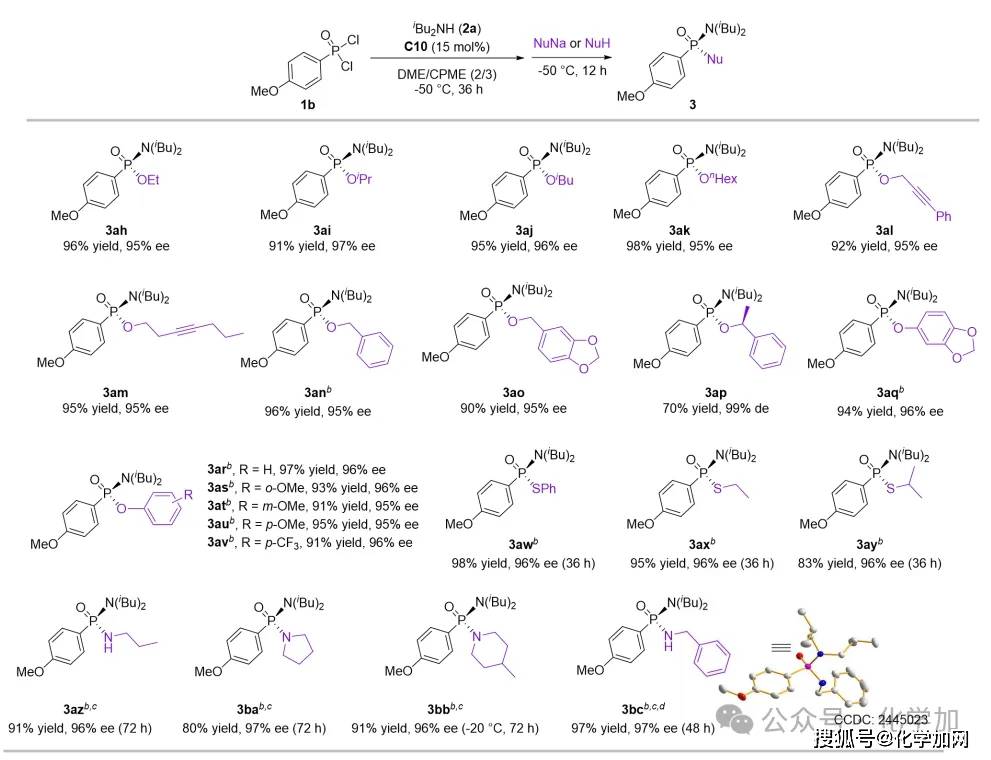
圖6 立體專一性SN2反應親核試劑拓展
接下來,作者以甲氧基苯基膦酰二氯作為底物(1b),二異丁胺為優勢二級胺,所得的手性氯代膦酰胺酯中間體通過“一鍋法”策略與多種親核試劑反應,從而高效地構建P-O/P-S/P-N鍵,實現了手性膦酰胺酯、膦酸酯、硫代膦酸酯以及膦酰二胺等有價值的化合物的合成。值得注意的是,當引入某些親核試劑(如部分醇鈉、酚鈉、硫醇鈉及胺類)時,目標產物的對映選擇性會出現顯著下降。作者將此歸因于:在第二步反應中,這些親核試劑進攻手性氯代膦酰胺酯,形成了一個五配位P(V)中間體。該中間體可經由Berry假旋轉途徑發生消旋化,從而造成了立體選擇性的損失。因此作者引入了添加劑碳酸銀,通過沉淀Cl-縮短五配位中間體的壽命。這使得反應能夠在其發生Berry假旋轉之前,優先沿立體專一的SN2路徑進行,從而維持了高對映選擇性。
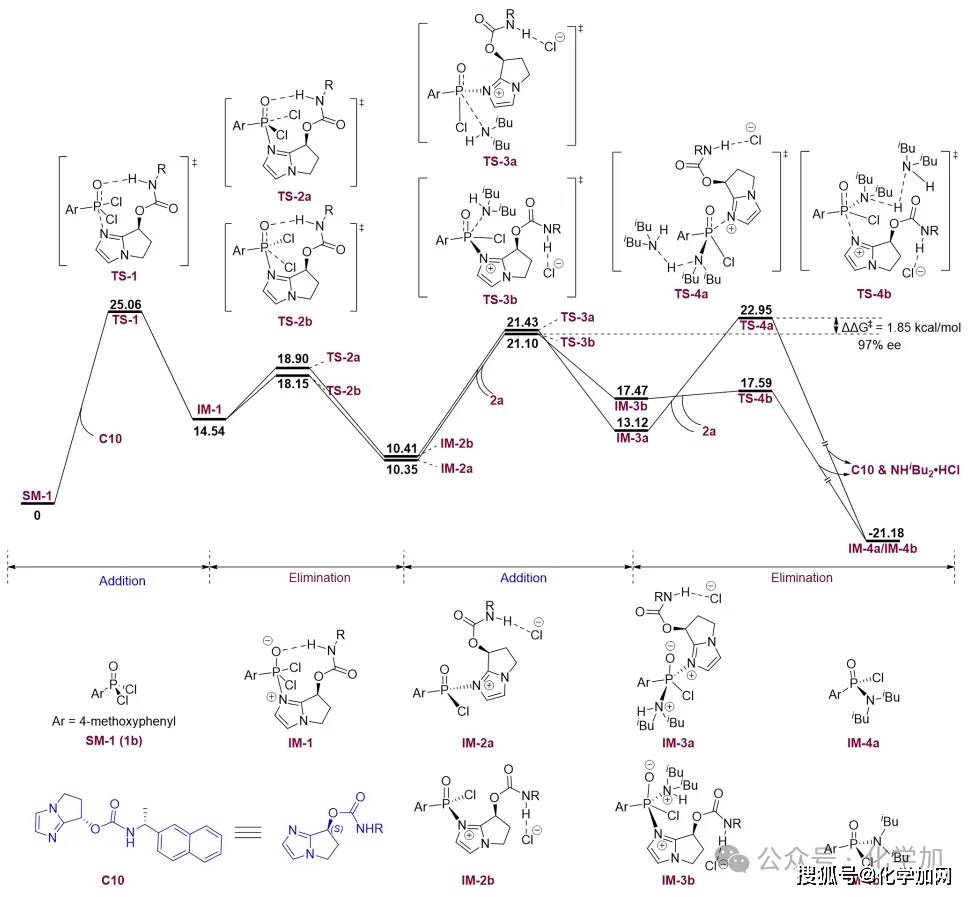
圖7 DFT計算
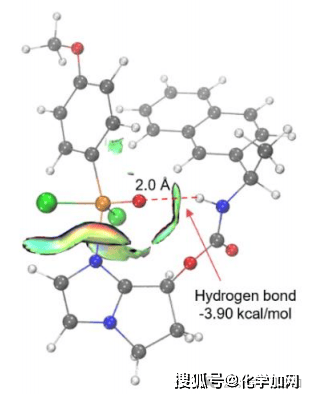
圖8 IGMH analysis between catalyst and substrate in TS-1.圖中原子顏色標示如下:碳原子為黑色,氫原子為白色,氮原子為藍色,氯原子為綠色,氧原子為紅色,磷原子為橙色。
研究團隊借助密度泛函理論(DFT)計算的手段,對反應進行了較為深入的研究(圖7)。根據能量分布圖,對映選擇性源于過渡態TS-3b和TS-4a之間的能量差,其值為 1.85 kcal/mol,計算出在-50 °C時的對映選擇性值為97%,與實驗數據(96% ee)基本吻合。此外,對TS-1的IGMH(圖8)分析表明,在P(V)物種的氧原子與催化劑的酰胺NH基團之間存在一個較強的氫鍵。該氫鍵通過有效穩定氧原子上的負電荷,對于增強P(V)中心的親電性起到了關鍵作用。
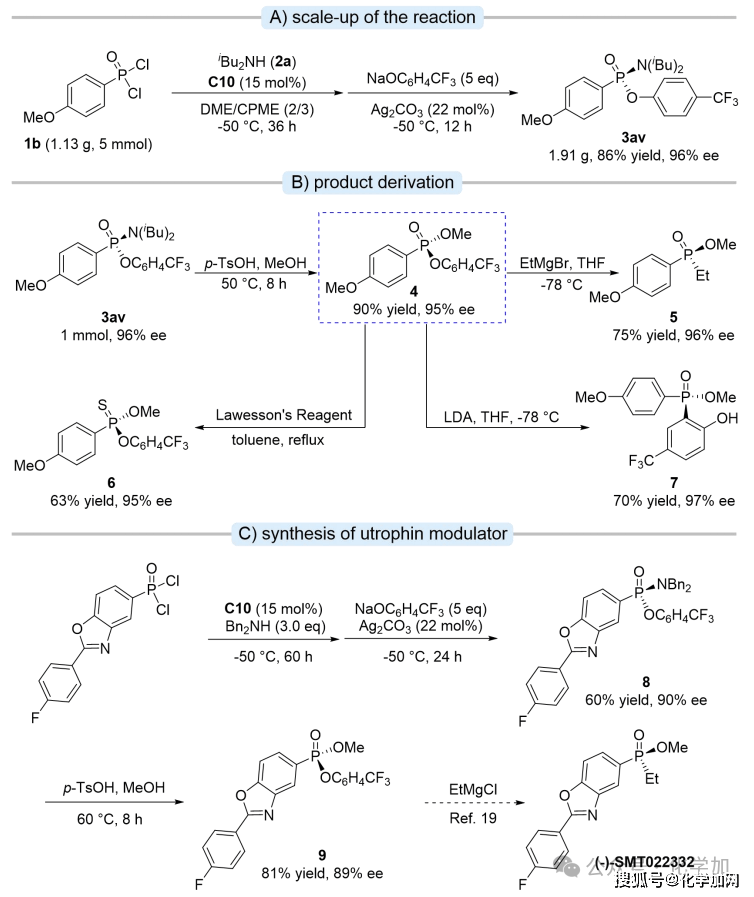
圖9 克級放大及產物衍生多樣性研究
接著,作者對該反應進行了克級規模放大,反應同樣能夠以高收率和優異的對映選擇性獲得手性產物(3av)(圖9A)。值得注意的是,化合物3av可通過對甲苯磺酸催化的醇解反應,將P-N鍵轉化為P-O鍵,高產率地得到手性膦酸酯,其對映選擇性在整個轉化過程中基本保持穩定。該手性膦酸酯化合物4又可以分別被格氏試劑、勞森試劑以及鋰化試劑進攻,生成P-C/P-S/P-C(Ar)化學鍵(圖9B)。為了進一步證明該方法的實用性,作者完成了對杜興氏肌營養不良癥候選藥物(-)-SMT022332的關鍵前體不對稱合成(圖9C)。以前手性膦酰二氯為原料,經由該催化體系去對稱化后,再進行醇解,便可獲得關鍵前體化合物9(81% yield, 89% ee)。
總結
綜上所述,上海交通大學張萬斌團隊使用課題組基于“鍵角調控”策略自主開發的手性雙環咪唑催化劑,將前手性膦酰二氯的去對稱化與立體專一的SN2親核取代反應相結合,一鍋法成功地構建了含C–P鍵的P(V)手性中心。該策略展現出優異的底物普適性與官能團兼容性,能以高產率和高對映選擇性合成至少55種結構多樣的手性膦氧化合物。機理研究證實,催化劑路易斯堿的親核作用以及關鍵的N–H…O=P氫鍵作用的協同催化機制,是實現高對映選擇性的核心。該方法的實用性在克級合成與藥物分子(-)-SMT022332關鍵前體的制備中得到成功驗證,為手性膦氧化合物的合成提供了一個強大平臺。上述研究成果近期發表在J. Am. Chem. Soc.上,上海交通大學藥學院博士生張露為論文的第一作者,化學化工學院張萬斌教授和藥學院張振鋒研究員為論文的通訊作者。
文獻詳情:
Asymmetric Synthesis of Diverse P(V) Compounds Bearing a C–P Bond via Desymmetrization of Phosphonic Dichlorides Catalyzed by a Chiral Bicyclic Imidazole
Lu Zhang, Mo Wang, Yicong Luo, Zhenfeng Zhang*, Delong Liu, Wanbin Zhang*
J. Am. Chem. Soc. 2025
https://doi.org/10.1021/jacs.5c17437
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn