

正文
α,β-不飽和羰基是天然產物和藥物分子中最常見的藥效團之一,存在于約六分之一的已知天然產物中。對這些分子進行后期C-H鍵氧化,可以快速得到結構類似物和代謝物,用于構效關系研究和新藥研發。然而,實現這一目標面臨兩大挑戰:1)化學選擇性難題,α,β-不飽和羰基中的C=C雙鍵本身極易被氧化(如發生環氧化反應),其旁邊的烯丙位C-H鍵由于鍵解離能較低,也容易被傳統的自由基氧化過程優先進攻。這使得選擇性氧化遠處、惰性更強的亞甲基(-CH?-)變得極其困難。2)現有方法的局限性,此前已發展的方法,如自由基羥基化和傳統的錳/鈀配合物催化,要么傾向于進攻烯丙位,要么對C=C雙鍵的環氧化與亞甲基氧化的選擇性不佳,導致無法實現專一的遠程氧化(圖1a)。歡迎下載化學加APP到手機桌面,合成化學產業資源聚合服務平臺。
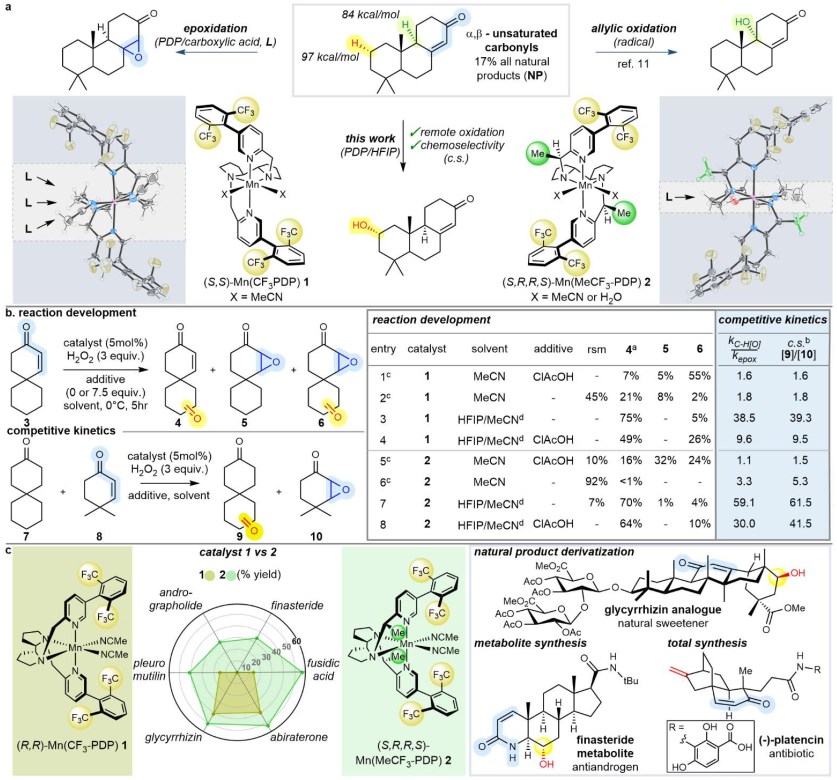
圖1. 反應設計和發展(圖片來源:Nature)
White團隊的核心思路不是尋找一個全新的催化劑,而是通過巧妙改變催化體系的微環境,從根本上調控活性氧化中間體的性質和反應性。作者系統研究了他們之前發展的錳-PDP催化劑體系,發現傳統體系(Mn(CF?-PDP)1/CH?CN/CIAcOH)在羧酸添加劑存在下,生成的活性氧物種(被認為是Mn(IV)(oxo)(carboxylate))對亞甲基氧化和C=C雙鍵環氧化具有相近的反應速率(kC-H/kepox ≈ 1.6),導致選擇性差。而創新體系(Mn(CF?-PDP)1/HFIP /無羧酸)當移除羧酸添加劑并將溶劑換為六氟異丙醇HFIP后,反應的選擇性發生了翻天覆地的變化。亞甲基氧化被極大加速,而環氧化被顯著抑制,選擇性比值kC-H/kepox達到了驚人的38.5。
HFIP是一種強氫鍵供體、高介電常數的特殊溶劑,已知能穩定陽離子自由基中間體。機理研究表明,在HFIP中,反應路徑發生了關鍵轉變:更“帶電”的途徑中,HFIP穩定了更具電荷分離特性的反應中間體,使得反應機制從相對“中性”的自由基路徑轉向更“帶電”的陽離子自由基路徑,不利于缺電子烯烴,這種帶電途徑不利于進攻同樣缺電子的α,β-不飽和羰基雙鍵,從而極大地抑制了環氧化反應。同時,它加速了對富電子亞甲基的進攻。Hammett分析(ρ值從-1.9變為-3.1)有力地支持了這一機理轉變。
為了進一步鞏固這一優異的選擇性,并防止羧酸偶然存在時導致的性能下降,作者設計并合成了新一代催化劑 Mn(MeCF?-PDP) 2。設計理念是在原有催化劑1的骨架基礎上,在朝向金屬中心的芐位引入甲基,從側面空間上阻擋羧酸與金屬中心的配位。催化劑2即使在有羧酸存在的情況下,也能保持很高的化學選擇性(kC-H/kepox僅從59.1降至30.0),并且在對復雜底物的氧化中,通常表現出比催化劑1更高的產率、更好的質量平衡和選擇性。
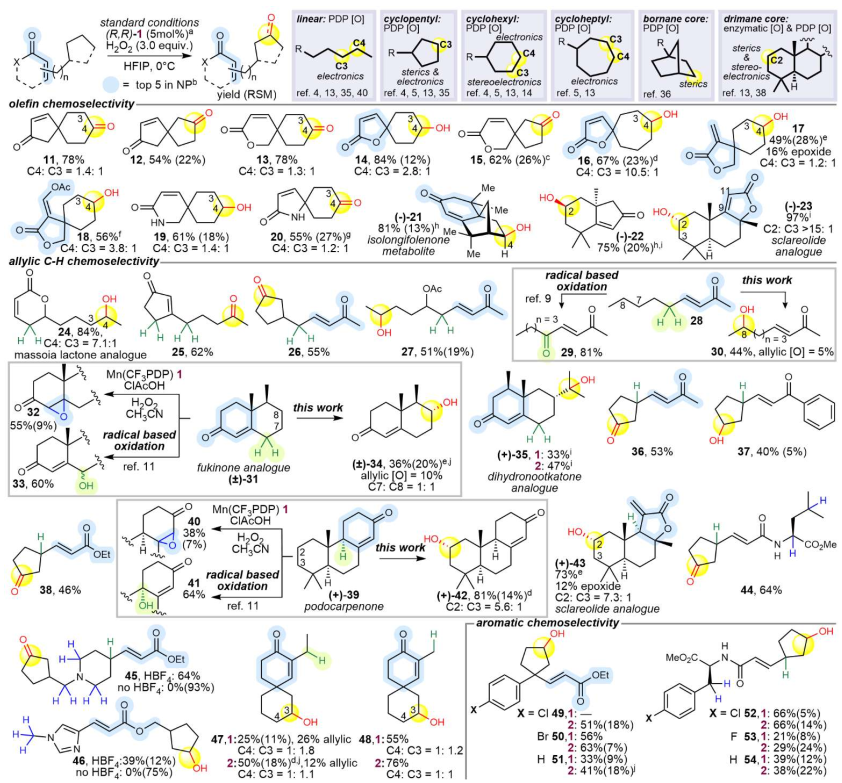
圖2. 底物范圍(圖片來源:Nature)
接著,作者通過大量、系統的底物范圍測試(共45個分子),充分證明了該方法的普適性、預測性和實用性。五大類常見α,β-不飽和羰基母核包括環己烯酮、環戊烯酮、γ-內酯、δ-內酯、α-外亞甲基丁內酯等,均能以良好產率獲得預測的遠程亞甲基氧化產物,僅觀察到痕量或無環氧化物。含弱烯丙位C-H鍵的底物:該方法成功規避了BDE導向的烯丙位氧化,專一地發生在電子和空間效應更優的遠程亞甲基上。含三級烯丙位或α-雜原子C-H鍵的底物:盡管這些位點活性很高,該方法依然能實現有用的遠程氧化產率,尤其在復雜分子中,當這些活性位點因空間位阻或電子因素被鈍化時,產率更佳。未保護的酰胺:無需像傳統方法那樣進行保護,可直接實現遠程氧化,簡化了步驟(圖2)。massoia內酯的氧化反應以良好收率和位點選擇性得到天然內酯24(84%,C4:C3=7:1),未觀察到烯丙位C-H鍵氧化。含兩個烯丙位的環戊烯酮底物以良好收率獲得電子效應優先亞甲基的氧化產物25(62%),僅觀察到單一區域異構體。柔性鏈狀烯酮因烯丙位C-H鍵的空間可及性而成為挑戰性底物,含高烯丙位取代的底物能實現遠程氧化,分別以良好的產率得到26和27。
為凸顯該體系與已知方法的差異性,31經Mn(CF3-PDP)1/HFIP氧化主要獲得遠程亞甲基氧化產物34(收率36%,物料平衡56%)。改用空間位阻更大的催化劑2并未顯著改變31的反應進程,但在結構類似的dihydronootkatone中有效改善了化學選擇性,使35的收率從33%提升到47%。
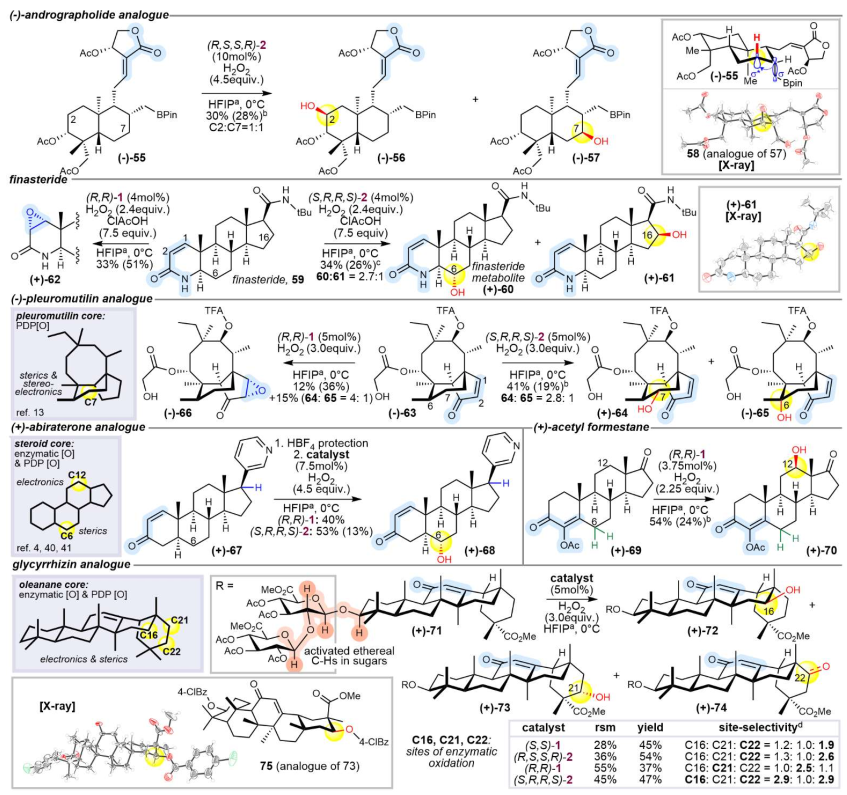
圖3. 含α,β-不飽和羰基官能團的天然產物衍生物和藥物的遠程氧化(圖片來源:Nature)
在天然產物中引入羰基鄰位不飽和鍵具有操作簡便性,且具備調控生物活性的潛力(圖3)。在復雜天然產物和藥物分子中的應用亮點是該研究最精彩的部分,它展示了該方法在真實、復雜場景下的強大能力。對于穿心蓮內酯衍生物,成功在具有抗炎活性的二萜分子骨架上實現了C2和C7位的選擇性氧化,且催化劑手性可以調控氧化的主要位點((R,S,S,R)-2得到C2和C7產物,而(S,R,R,S)-2只得到C7產物)。非那雄胺:成功在該合成類固醇藥物的Δ1,2-不飽和內酰胺骨架上,氧化了甾體核心的C6位,直接獲得了其已知代謝物。使用空間位阻催化劑2并加入CIAcOH是實現這一轉化的關鍵。甘草酸Glycyrrhizin:首次在如此復雜的五環三萜糖苷上實現了非導向的遠程亞甲基氧化,在D/E環上獲得了C16, C21, C22位的氧化產物,其中C21和C22位的化學氧化是前所未有的。催化劑的骨架手性同樣可以調控主要氧化位點。在高度官能團化的Fusidic acid側鏈類似物中,成功氧化甾體C6位,并通過X-射線晶體學確認了不常見的平伏-直立羥基化立體化學,揭示了分子獨特的構象。特別值得關注的是,在復雜底物(55、59、63、67、71和77)的氧化反應中,Mn(MeCF?-PDP) 2在收率和物料平衡方面普遍優于Mn(CF?-PDP) 1。
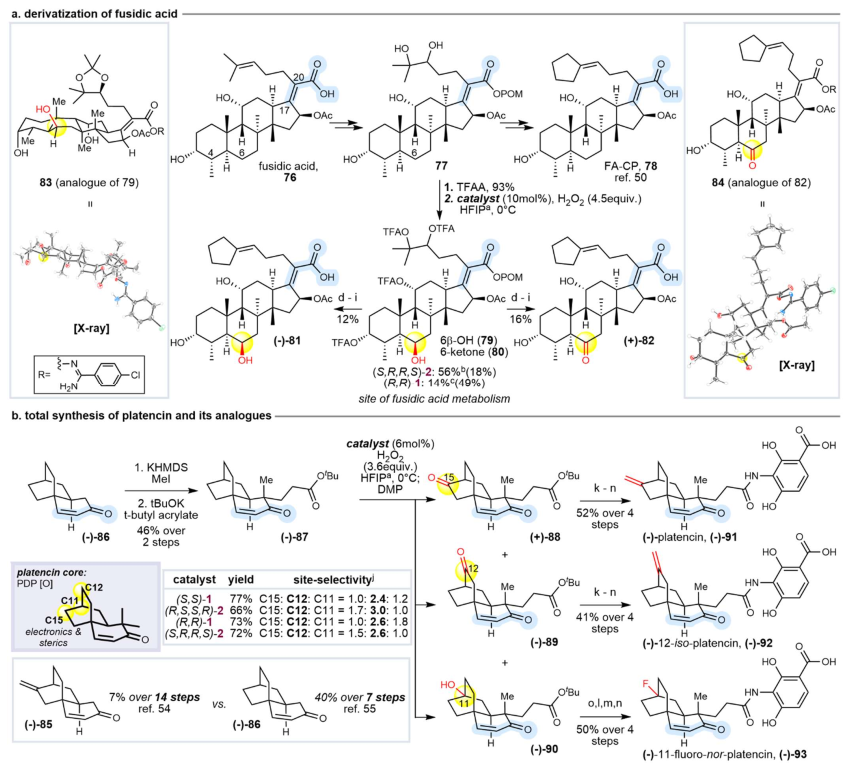
圖4. 獲取天然產物及其類似物和代謝物的遠程氧化(圖片來源:Nature)
Platencin的全合成應用:該方法被用于簡化Platencin核心結構的后期官能團化,從一個共同中間體出發,通過選擇性C-H氧化,一舉合成了天然產物Platencin本身和兩個新穎類似物,極大地簡化了合成路線,展示了其在多樣性導向合成中的巨大潛力。
總結
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn