

碳-糖苷因其優于氧-和氮-糖苷的代謝穩定性,使其在藥物開發中備受關注。然而,如何高效合成碳-糖苷仍面臨巨大挑戰。天然糖類多羥基的存在使得反應的化學和位點選擇性難以控制,自然界生物體內“分子機器”的精準合成,為化學家開發新型合成策略提供了關鍵靈感。近日,南開大學何剛團隊開發了一種仿生“開-關”策略,實現了從天然無保護醛糖直接合成1,2-順式烯基呋喃碳-糖苷。該方法具有以下亮點:(1)直接使用無保護醛糖,無需保護和脫保護操作;(2)底物適用范圍廣,兼容多種無保護醛糖與烯基硼酸;(3)操作簡便,條件溫和,立體選擇性高(α/β最高 >20:1),可克級放大;(4)經烯基糖苷的下游轉化可快速獲取具有挑戰性的1,2-順式烷基呋喃碳-糖苷。該工作為合成無保護呋喃型碳-糖苷及開發碳-糖苷類藥物與功能材料提供了新思路,相關工作近期發表在Journal of the American Chemical Society 期刊上。
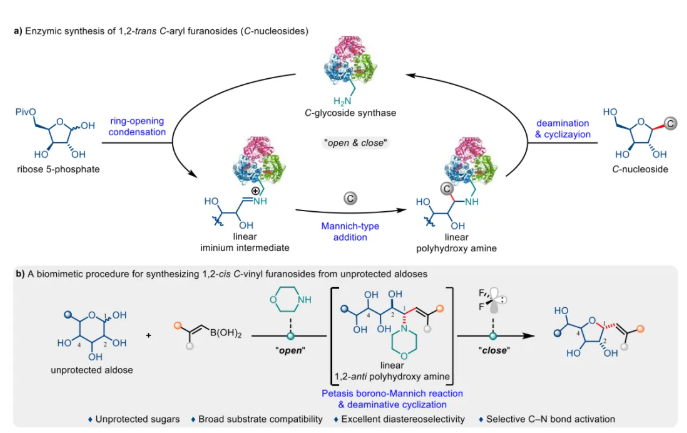
圖1. 背景介紹與反應設計
該方法展現出優異的底物普適性。多種芳基或雜芳基乙烯基硼酸、直鏈、環狀和多烷基取代的烯基硼酸,以及炔基硼試劑和芳基硼酸均可兼容,以良好的產率和良好至優異的非對映選擇性得到目標產物(圖2a)。此外,該方法也適用于雌酮等天然產物和藥物分子的糖基化(圖2b),并對多種天然單糖和二糖同樣表現出廣泛兼容性(圖2c)。
該策略還具有良好的合成應用潛力(圖2d),包括“一鍋法”、克級實驗以及呋喃碳-糖苷的衍生化。值得一提的是,通過該研究團隊開發的仿生“開-關”策略,從商業可得的L-木糖出發,只需3步即可克級制備熱致液晶材料(圖2e)。傳統路線需從D-葡萄糖經9步操作且涉及鋰試劑和低溫等嚴苛條件,作者的方案提供了一條更高效獲取該類結構的途徑。
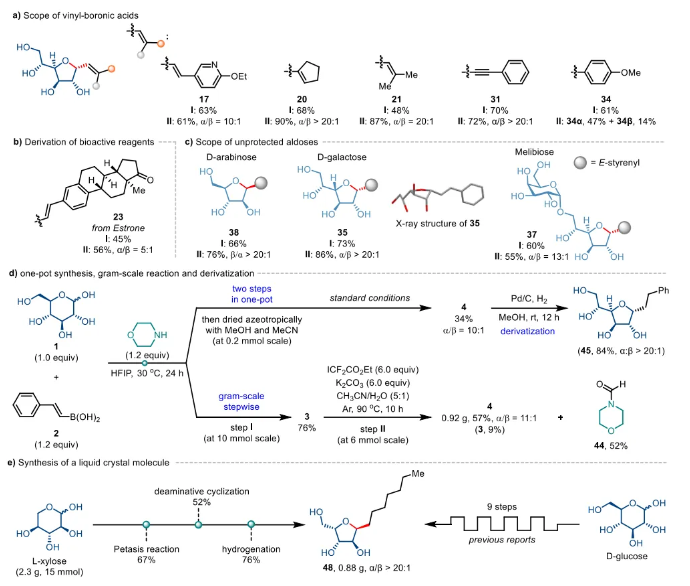
圖2. 底物范圍與合成應用
控制實驗(圖3a)為反應機理提供了關鍵證據:1)D?O的使用顯示主產物未被氘代,副產物(44-D)源自中間體水解;2)二氟卡賓捕獲實驗顯著抑制環化,分離產物49證明了二氟卡賓的參與。基于以上結果和先前的報道,作者提出了可能的機理:1)開環與C–C鍵形成:嗎啉與醛糖生成亞胺中間體,經TS-I實現乙烯基遷移;2)C–N鍵活化:二氟卡賓與嗎啉單元依次形成葉立德Int-II與季銨鹽Int-III,活化烯丙基C–N鍵;3)SN2關環:C4羥基進行分子內SN2環化,得到異頭碳構型翻轉的1,2-順式呋喃碳-糖苷產物(圖3b)。
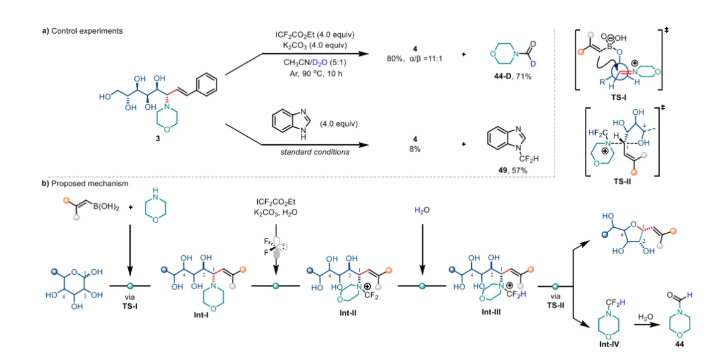
圖3. 機理研究
總結
綜上,南開大學何剛團隊開發了一種仿生“開-關”策略,可直接從無保護醛糖高效合成1,2-順式烯基呋喃碳-糖苷。該策略的核心過程1)“開”:通過嗎啉充當C-糖苷合酶中賴氨酸殘基的角色介導醛糖開環,并與烯基硼酸經Petasis反應構建C–C鍵;2)“關”:利用二氟卡賓活化C–N鍵,觸發分子內SN2脫胺環化,最終高效構建1,2-順式烯基呋喃碳-糖苷。
相關工作近期發表在J. Am. Chem. Soc.上,南開大學何剛教授為本文通訊作者,南開大學2022級博士研究生孫東陽為論文第一作者,碩士研究生竇雪瑞也對該工作做出了重要貢獻。
導師簡介:http://www.gongchenlab.com/col.jsp?id=101
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn