

(圖片來源:Nat. Chem.)
正文
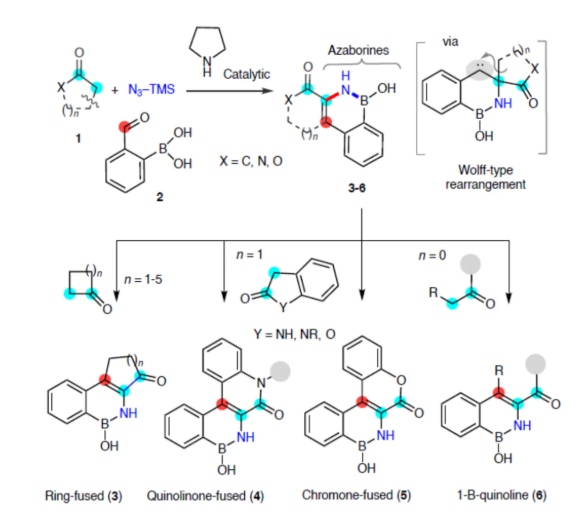
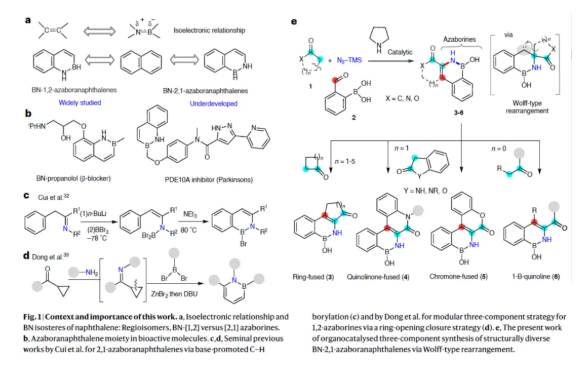
在藥物設計中,對優勢分子骨架進行多樣化修飾以改善物化性質是開發新藥候選化合物的關鍵所在。為實現核心骨架的定向結構轉化,通常需要從頭進行多步合成,從而降低整體合成效率并延長研發周期。近年來,生物電子等排體替換化學已成為修飾現有生物活性化合物的重要工具,該技術能系統性地調控相關化合物的整體藥理活性。此外,通過構建與C=C鍵電子等排的共價B-N鍵來創制新型含硼雜環化合物,已引發合成化學、藥物化學及材料化學領域研究者的廣泛關注。特別是,苯并氮雜硼烷,這是一類硼氮雜環,作為萘類化合物的獨特BN等排體(Fig. 1a)。與母體萘分子相比,這類化合物通常表現出更優的治療特性,如增強的代謝穩定性和水溶性(Fig. 1b)。盡管BN等排體展現出巨大潛力,但目前報道的合成策略仍十分有限,且存在一定局限性。此外,目前大多數研究進展集中在BN-1,2-氮硼雜萘(亦稱2,1-硼氮雜萘)異構體的合成上。相比之下,區域-反轉結構BN-2,1-氮硼雜萘(或1,2-硼氮雜萘)類似物的制備方法仍處于待開發階段,其最早由崔春明團隊在2015年進行相關的研究,涉及苯乙基亞胺、丁基鋰與鹵代硼烷反應以及親電環化的過程(Fig. 1c)。此外,盡管BN-2,1-氮雜硼萘通常存在底物范圍有限且需要苛刻反應條件的問題,但已報道了其雙組分合成策略。在這些方法中,2-甲酰基苯硼酸通過與α-氨基酯或羰基化合物發生醛縮或Wittig型反應,實現了非外圍(non-peripheral)氮雜硼環的合成。2024年,董廣彬團隊開創性地報道了一種三組分兩步法制備單環1,2-氮雜硼環的方法,涉及環丙基酮與胺形成亞胺,并在ZnBr2-催化下與二溴化硼進行開環的過程(Fig. 1d)。近日,Ravindra Kumar團隊報道了一種酮類化合物、2-甲酰芳基硼酸與TMSN3的有機催化三組分偶聯反應,合成了一系列BN-2,1-氮雜硼萘衍生物,涉及環烷酮或酮的[1,2]-遷移和擴環的過程(Fig. 1e)。歡迎下載化學加APP到手機桌面,合成化學產業資源聚合服務平臺。
(圖片來源:Nat. Chem.)
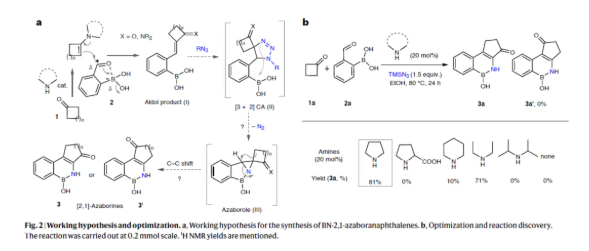
最初,作者假設了一種合成BN-2,1-氮雜硼萘衍生物的過程(Fig. 2a)。酮類化合物(1)與苯硼酸2的活性甲酰基團通過亞胺/烯胺催化形成羥醛縮合中間體(I)。疊氮化物可能會通過[3+2]環加成反應引入到活化的烯烴(I)中,形成螺環二氫三唑(II)。通過進一步的釋放氮氣,可生成穩定的B–N鍵。由于環張力作用,后續會通過[1,2] C–C重排形成[2,1]-苯并氮硼雜環化合物(3和3′)。該過程也可能通過螺環氮丙啶的形成途徑實現。通過對反應條件的優化后發現(Fig. 2b),當以環丁酮(1a)、2-甲酰基苯基硼酸(2a)作為底物,TMSN3(1.5 equiv.)作為疊氮源,吡咯烷(20 mol%)作為催化劑,在EtOH溶劑中80 oC反應24 h,可以81%的收率得到環戊酮稠合[2,1]-氮硼雜環化合物產物3a。
(圖片來源:Nat. Chem.)
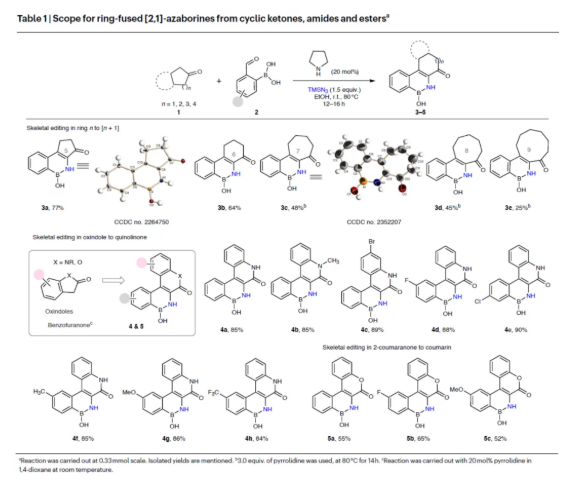
在獲得上述最佳反應條件后,作者對合成環稠合[2,1]-氮硼雜環化合物的底物范圍進行了擴展(Table 1)。首先,幾種不同環尺寸(n = 5-9)的環酮,均可順利進行反應,獲得相應的產物3a-3e,收率為25-77%。其次,2-吲哚酮可進行1C擴環反應,得到喹啉酮稠合氮硼雜環產物4a-4h,收率為84-90%。此外,2-苯并呋喃酮,也是合適的底物,獲得相應的香豆素環稠合氮硼雜環產物5a-5c,收率為52-65%。
(圖片來源:Nat. Chem.)
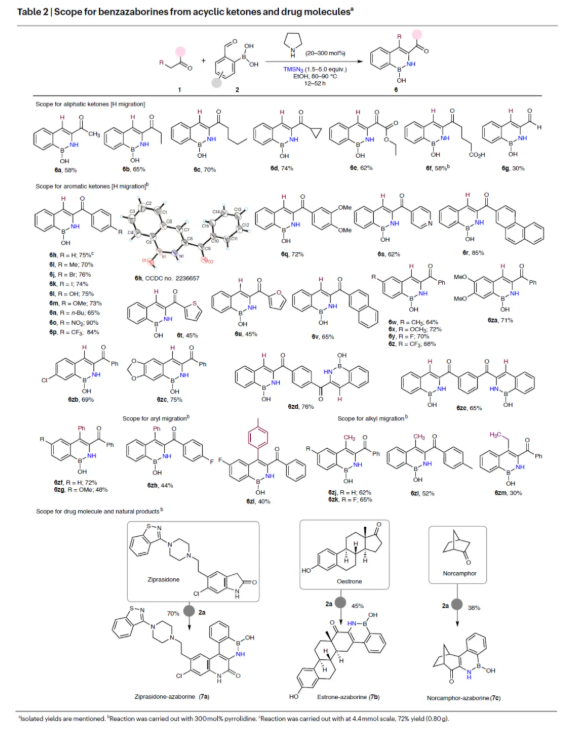
緊接著,作者對合成苯并氮硼雜環化合物的底物范圍進行了擴展(Table 2)。首先,不同取代的脂肪酮底物,均可順利進行反應,獲得相應的產物6a-6g,收率為30-74%。一系列不同電性取代的芳基酮、雜芳基酮以及稠環芳烴酮,也能夠順利進行反應,獲得相應的產物6h-6v,收率為45-90%。其次,不同電性取代的2-甲酰基芳基硼酸,也與體系兼容,獲得相應的產物6w-6zc,收率為64-75%。當以1,4-和1,3-二乙酰苯為原料時,可分別獲得雙氮硼雜環產物6zd(收率為76%)和6ze(收率為65%)。此外,除了上述的氫遷移外,該策略還可實現芳基與烷基的遷移,獲得相應的產物6zf-6zm,收率為30-72%。值得注意的是,該策略成功實現了天然產物與藥物分子的后期衍生化,如齊拉西酮、降樟腦和雌酮,獲得相應的衍生物7a-7c,收率為38-70%。
(圖片來源:Nat. Chem.)
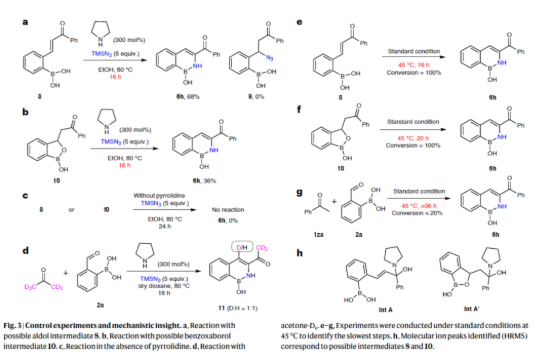
隨后,作者對反應的機理進行了研究(Fig. 3)。首先,醛醇中間體8在標準條件下,可以68%的收率得到目標產物6h,且未生成Michael加成疊氮產物9(Fig. 3a)。同時,由查耳酮/醛醇產物8生成的苯并噁硼戊環中間體10在標準條件下,也可以36%的收率得到目標產物6h(Fig. 3b)。因此,化合物8可能是形成目標產物6h的主要中間體,甚至是唯一的中間體。然而,在體系中無吡咯烷時,中間體(8或10)均未能生成目標產物6h,從而表明了吡咯烷在后續步驟中具有重要的作用(Fig. 3c)。其次,氘代實驗結果表明,丙酮-D6的CD3基團發生了[1,2]-氘轉移(Fig. 3d)。此外,化合物8、10與1za/2a分別在標準條件下(45 oC)進行的對照實驗結果表明,中間體(8或10)的形成過程,可能是該方法中最慢的步驟(Fig. 3e-3g)。同時,通過HRMS分析,進一步證明了反應過程中形成了中間體8和10(Fig. 3h)。
(圖片來源:Nat. Chem.)
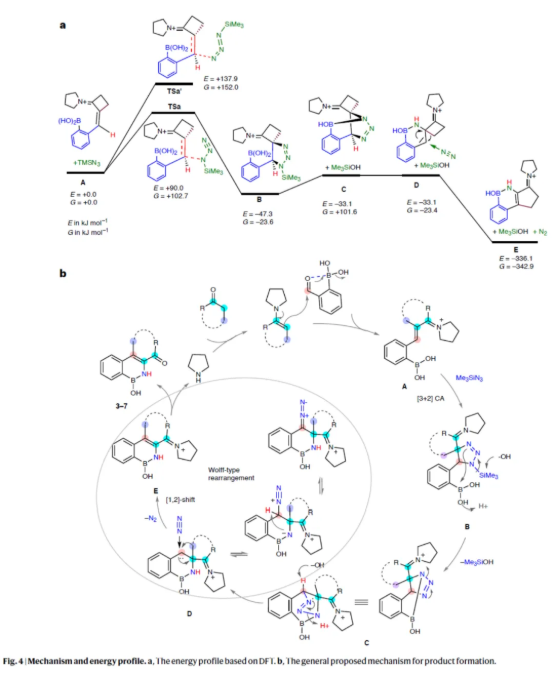
最后,作者進行了相關的理論計算的研究,并提出了一種合理的反應機理(Fig. 4)。首先,在吡咯烷存在下,原位形成亞胺離子中間體A。亞胺離子中間體A中的烯基單元與TMSN3進行1,3-偶極環加成反應,生成螺二氫三唑中間體B。DFT計算表明,TMSN3加成的區域選擇性主要受動力學控制。由于硼的親電性質,中間體B可形成B-N鍵,通過消除Me3Si-OH,生成橋聯型中間體C。隨后,具有張力以及不穩定的二氫三唑環中間體C進行開環,并釋放氮氣,從而生成卡賓或重氮型中間體D,其可繼續進行[1,2]-C-C或C-H遷移,類似于Wolff-型重排,生成中間體E。[1,2]-遷移是由熱力學穩定的中間體E的形成所驅動的。最終,中間體E經水解后,獲得目標產物。
(圖片來源:Nat. Chem.)
總結
Ravindra Kumar團隊報道了一種全新的有機催化策略,實現了非張力環狀酮(n = 4-8)的擴環反應,并通過Wolff-型重排完成了[2,1]-苯并氮硼雜環化合物的模塊化合成。該策略利用環狀酮、2-甲酰基硼酸和TMSN3作為外源單一氮源,高效構建了環稠合[2,1]-苯并氮硼雜環化合物的三組分合成體系。該策略同樣適用于非環狀酮,通過氫、芳基和烷基的[1,2]-遷移反應生成BN萘環等排體。該反應具有高效且可擴展性,廣泛的底物范圍及優異的官能團兼容性,特別適用于將優勢骨架和藥物分子修飾為潛在高價值的氮硼雜環類似物。該方法不僅豐富了BN雜環化學的工具箱,也為藥物發現中的分子編輯和生物等排體替換提供了新思路。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn