

圖片來源:J. Am. Chem. Soc.
正文
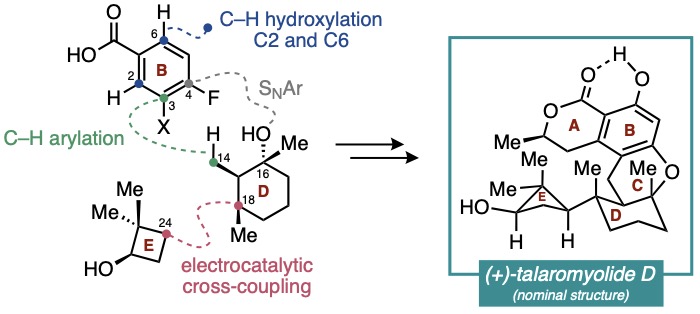
Talaromyolide A-D (1-4)是由海洋真菌Talaromyces sp. CX11產生的一類雜萜類天然產物。該系列化合物擁有類似的6/6/6稠合二氫異香豆素核心骨架,并以D/E環結構的差異加以區分。其中,talaromyolide D具有罕見的嵌在四個連續手性中心(且其一為季碳中心)中的二甲基環丁醇E環,增加了其全合成挑戰性。此外,talaromyolide D(4)展現出顯著的抗偽狂犬病毒(PRV)活性(CC50 3.35 μM)。復雜的結構及潛在的生物活性使talaromyolide D (4)的全合成極具價值。目前為止,尚無關于talaromyolides的全合成報道。近日,紐約大學Martin Tomanik課題組首次報道了(+)-talaromyolide D標稱結構的不對稱全合成。作者在逆合成分析(Figure 1)中提出talaromyolide D(4)中的A環內酯及C6位酚羥基可分別通過C1位羧基導向的串聯C(sp2)-H烷基化/內酯化反應和C(sp2)-H氧化反應獲得。中心C環則可由氟代苯11與三級醇10通過C(sp3)-H芳基化反應和分子內SNAr反應雙重連接構建。三級醇10可由烯酮12經串聯1,4-加成/烷基化,烯基化和水合反應制備。而烯酮12則可通過環丁烷衍生物13與烯基碘14在Baran課題組發展的鎳催化的電化學偶聯條件下獲得(Figure 1)。
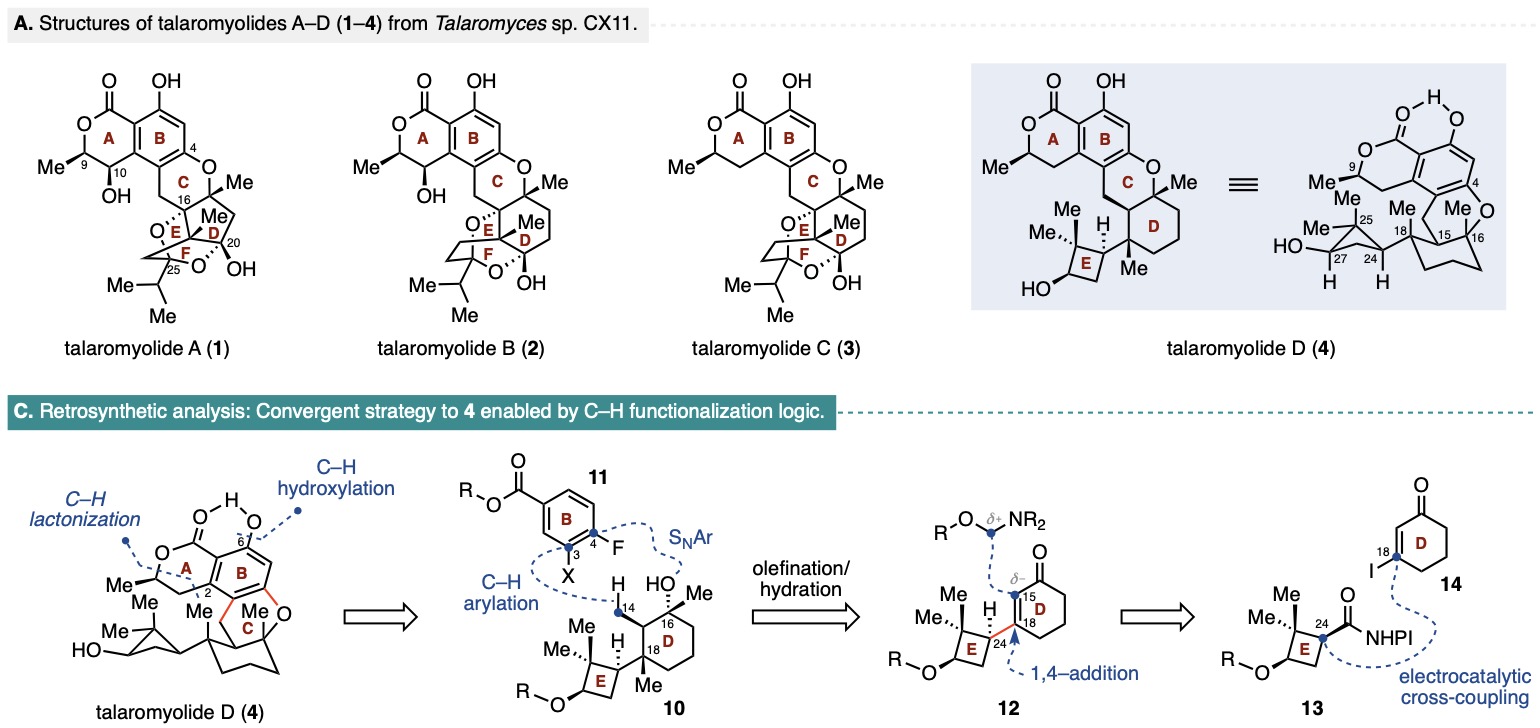
Figure 1. (A) Structures of talaromyolides A–D (1–4); (C) Retrosynthetic analysis of 4.
圖片來源:J. Am. Chem. Soc.
作者以商業易得的原料(?)-verbenone (15)為起始 (Scheme 1)。首先通過Ru-NaIO4氧化裂解,Baeyer-Villiger氧化及EDC偶聯,在十克級規模上以三步71%的總產率得到氧化還原活性酯16。隨后,采用Baran課題組發展的鎳催化的電化學偶聯,成功將16與17偶聯,以85%的產率(非對映異構體比例11:1)獲得烯酮20及其非對映異構體。20的絕對構型由其衍生物21的單晶結構得以確認。值得注意的是,偶聯過程中的立體保留可能源自于環丁烷自由基中間體18的優勢構象。該構象使C27位乙酰氧基與C25位兩個甲基的非鍵相互作用最小化,同時自由基SOMO軌道與臨近C-C鍵重疊最大化。Ni(II)中間體19還原該自由基時,反應優先沿凸面進行,從而生成20。為驗證這一假設,作者制備了酯16及其C-24位非對映異構體的混合物(Scheme 2),并在相同條件下進行偶聯,所得產物顯示出相同的非對映異構體比例,進一步證明中間體18為優勢構象并決定了產物比例。
為實現后續C-H活化反應,需在C15和C18位置引入兩個β-甲基。作者首先通過串聯1,4-加成/烷基化及Cope消除反應,以兩步73%的產率(非對映異構體比例3:1)獲得烯酮23。進一步還原雙鍵,并在酸性高溫條件下異構化得到了熱力學穩定的酮24(非對映異構體比例5:1)。隨后,24與甲氧基胺縮合,并經MOM保護得到C-H活化前體26。利用陳超課題組發展的肟醚導向的C(sp3)-H芳基化反應,作者成功將肟醚26以82%的產率轉化為27。由于肟醚基團所處空間位阻較大,其水解在多種條件下難以進行,最終作者發現通過低價鈦試劑還原N-O鍵,再經硼酸水解所得亞胺中間體,可成功將27水解。產物酮經Wittig反應,三步以52%的產率獲得烯烴29。隨后,作者借助Armido Studer課題組發展的Mukaiyama類型的水合反應以單一異構體的形式得到相應三級醇中間體,產物與氫化鈉共熱至90 ℃,順利發生分子內SNAr反應,成功構建起C環得到中間體30。
在獲得關鍵中間體30后,需要通過系列C-H活化反應實現氧化態調控及內酯環的構建。作者首先將30水解為酸31,在余金權課題組發展的雙齒配體L1-過氧化氫條件下,得到了C2和C6位的兩種氧化產物。為實現選擇性C6位的氧化,作者進一步嘗試余課題組發展的雙齒配體L2-氧氣氧化條件,成功以大于20:1的異構體比例得到酚33。產物經甲基和芐基保護后水解為酸34。由于位阻較大,作者嘗試余課題組發展的串聯C-H烷基化/內酯化反應未得到目標產物(Scheme 2)。于是作者再次運用余課題組發展的L1-過氧化氫氧化,所得酚經甲基保護后生成酯39。39經三氟甲磺酰化和Stille偶聯引入烯丙基得到40,隨后通過Wacker氧化,CBS還原,和鹽酸促進的內酯化/脫保護反應順利構建A環得到38,最后經鈀碳氫氣還原脫芐,以99%的產率得到了(+)-talaromyolide D (4)。作者還通過X射線單晶衍射確證了合成產物的結構。
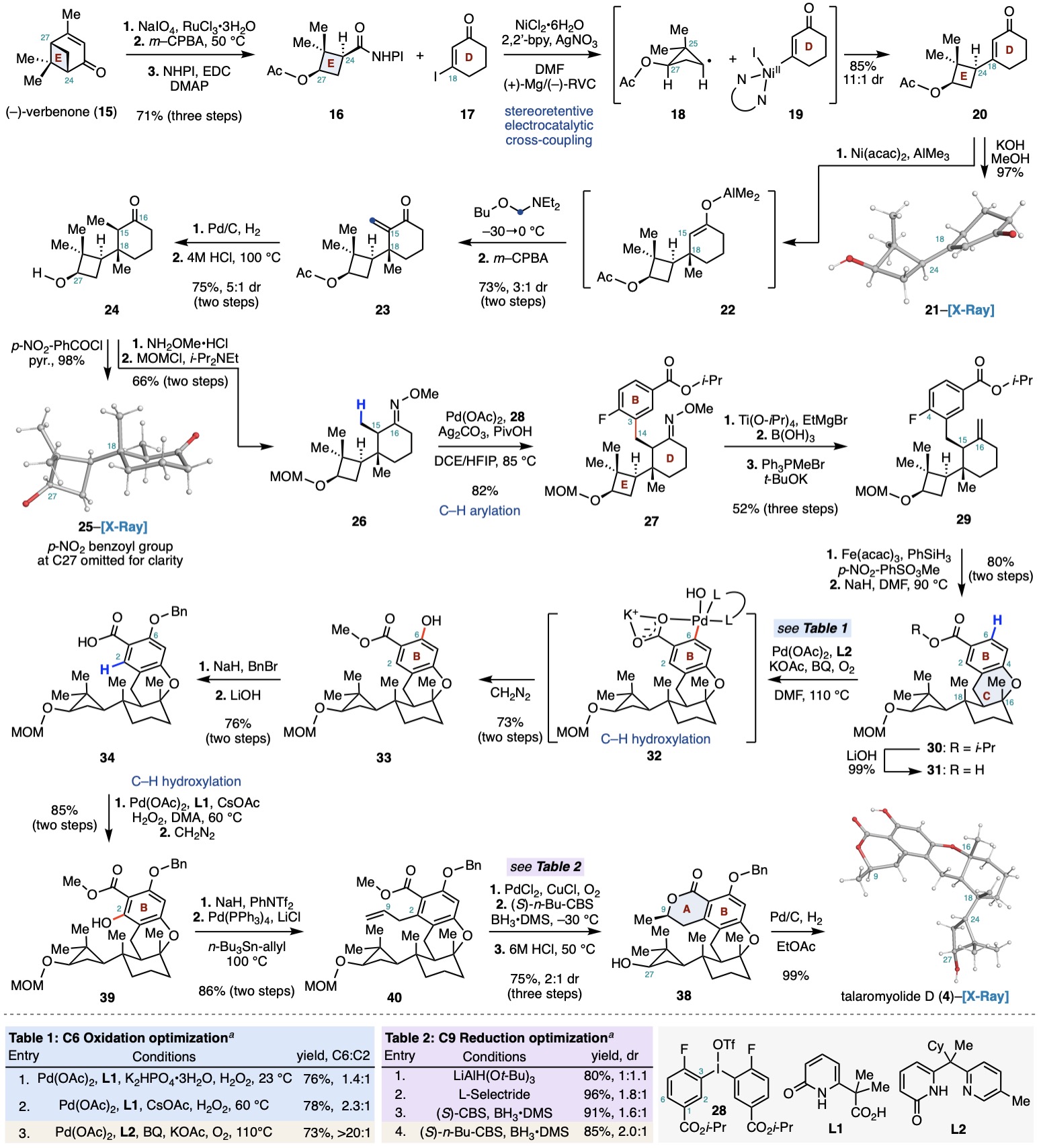
Scheme 1. Total synthesis of the nominal structure of (+)-talaromyolide D (4).
圖片來源:J. Am. Chem. Soc.
在獲得合成樣品并完成結構確證后,作者注意到合成樣品核磁數據與原始分離文獻報道不符。為尋找正確分子結構,作者對各手性中心進行系統性調整,并利用密度泛函理論計算了33種可能異構體的13C核磁共振數據。結果表明,標稱結構的計算值與合成樣品核磁數據高度吻合,僅在C22位出現大于4 ppm的絕對誤差(Scheme 2)。但是所有 33 種異構體的計算數據與原始分離文獻報道的數據均存在顯著偏差,其中至少有 5 個以上化學位移的絕對誤差超過 4 ppm。這一結果表明原始分離文獻在骨架結構的鑒定上可能存在錯誤。
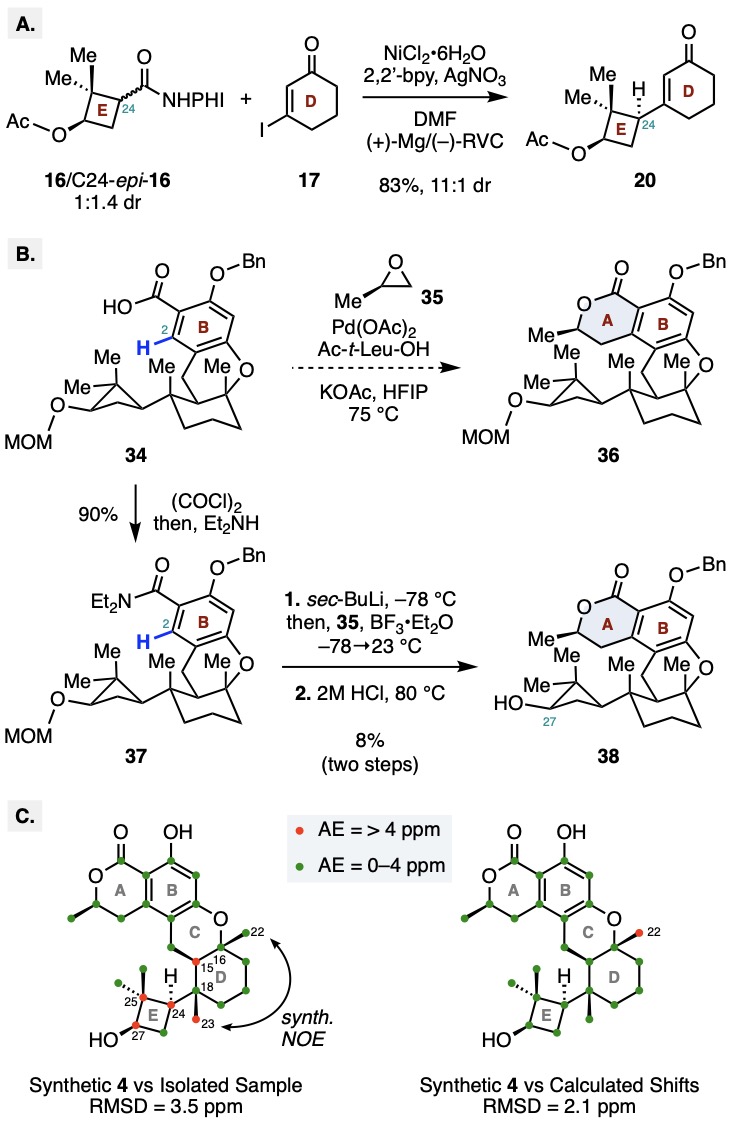
Scheme 2. (A) Electrochemical cross-coupling with a mixture of C24 diastereomers; (B) Selected efforts towards construction of the lactone A–ring of 4; (C) 13C NMR comparison data between isolated and synthetic talaromyolide D samples.
圖片來源:J. Am. Chem. Soc.
總結
紐約大學Martin Tomanik課題組以27步反應首次完成了(+)-talaromyolide D標稱結構的不對稱全合成。該合成巧妙運的用了三次鈀催化的C-H活化反應以調控氧化態并構建A/C環,借助立體保留的鎳催化的電化學脫羧交叉偶聯實現E/D環的構建,采用高度非對映選擇性的鐵催化 Mukaiyama 型烯烴水合反應,以及分子內 SNAr 反應構建中心C環。作者還通過密度泛函計算指出了原始文獻結構鑒定可能存在骨架錯誤,為后續結構修正提供了參考。
作者簡介
Martin obtained his PhD at Yale University under the mentorship of Prof. Seth Herzon, focusing on natural product total synthesis. In the summer of 2021, Martin moved to San Diego to pursue postdoctoral research in the laboratory of Prof. Jin-Quan Yu at The Scripps Research Institute. In 2023, he then joined the faculty at New York University as an assistant professor in the Department of Chemistry, where his lab’s research focuses on the synthesis of complex bioactive natural products and the development of new synthetic methods leveraging C–H functionalization chemistry.
課題組主頁:https://www.tomaniklab.com。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn