

正文
2025年8月19日,北京大學化學與分子工程學院,北大-清華生命科學聯合中心雷曉光團隊與美國加州大學洛杉磯分校的K. N. Houk 團隊在《PNAS》上在線發表研究論文,題為:"Aspartic acid residues in BBE-like enzymes from Morus alba promote a function shift from oxidative cyclization to dehydrogenation"。該工作對白桑(Morus alba)中類BBE酶催化的氧化環化與脫氫反應的催化機制以及選擇性進行了探究,證實了類BBE酶中的一個天冬氨酸殘基可以作為催化堿通過去質子化促進二烯產物的產生;而缺失該殘基則會導致氧化環化發生。
在實驗室的前期研究中,雷曉光課題組發現了桑科植物中類BBE酶具有催化氧化脫氫、氧化環化以及分子間Diels-Alder反應的活性,并且解析了白桑中分子間Diels-Alder反應酶的自然演化歷程(Nat. Chem. 2020, 12, 620; Nat. Catal. 2021, 4, 1059; Nat. Commun. 2024, 15, 2492; Acc. Chem. Res.2024, 57, 2166)。在這些類BBE酶中存在一些功能雜泛性酶,它們能夠同時催化氧化脫氫以及氧化環化反應的,比如MaDS1和MaDS6。這種功能雜泛性在類BBE酶中并不常見,氧化脫氫酶與氧化環化酶精確調控不同氧化路徑的分子機制仍不清楚。
在本研究中,作者首先分別解析了MaDS1-FAD(圖1A&B)以及MaDS1-FAD-氧化脫氫產物復合物的晶體結構,并在復合物晶體結構的基礎上用底物moracinC進行分子對接(圖1C),并根據分子對接結果進行了丙氨酸掃描突變試驗。結果表明Y116能夠與底物的酚羥基形成氫鍵相互作用,對于底物識別非常關鍵;而D175/R314/D410能夠形成氫鍵相互作用網絡輔助氧化脫氫反應的發生,其中D175對于氧化脫氫反應活性極為重要(圖1D&E)。
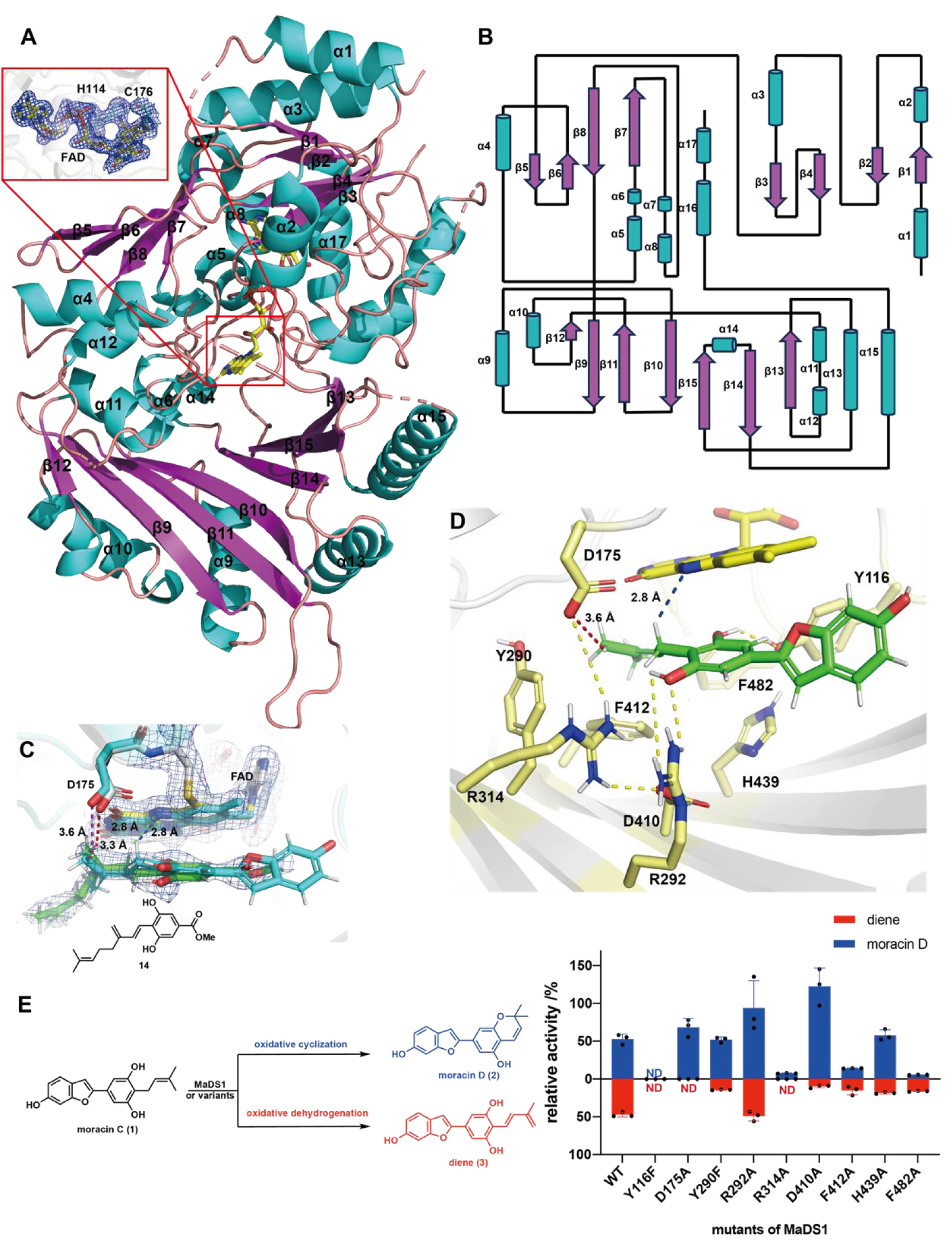
圖1.MaDS1晶體結構及基于結構的突變研究
隨后,通過同源序列比對,作者發現Y116在所有氧化酶中都是保守的,而D175和R314則在氧化脫氫酶中保守,在單功能氧化環化酶中對應D175的氨基酸則為較為疏水的L或者V,對應R314的氨基酸則為S,這也能夠表明D175和R314可能存在著共進化的關系(圖2A)。在晶體結構中,D175距離氧化脫氫中所需要被去質子化的甲基距離較近,因此作者推斷該氨基酸可能作為催化堿對底物進行去質子化,因而將該天冬氨酸突變為天冬酰胺或者谷氨酸,結果表明D175E突變體仍具有氧化脫氫的活性,說明D175的羧酸基團對于氧化脫氫活性至關重要(圖2B)。另外,在其他單功能氧化脫氫酶上講該天冬氨酸突變為纈氨酸能夠將其轉變為單功能的氧化環化酶,而在單功能氧化環化酶的該位置引入天冬氨酸基團也可以使其獲得氧化脫氫的活性。該結果證實了這一位點取代在氧化環化酶(OCs)向脫芳構化酶(DSs)進化過程中的關鍵作用。綜合上述發現,我們證實了D175位羧基對促進白桑(M. alba)BBE類酶催化氧化脫氫反應的重要功能(圖2C)。
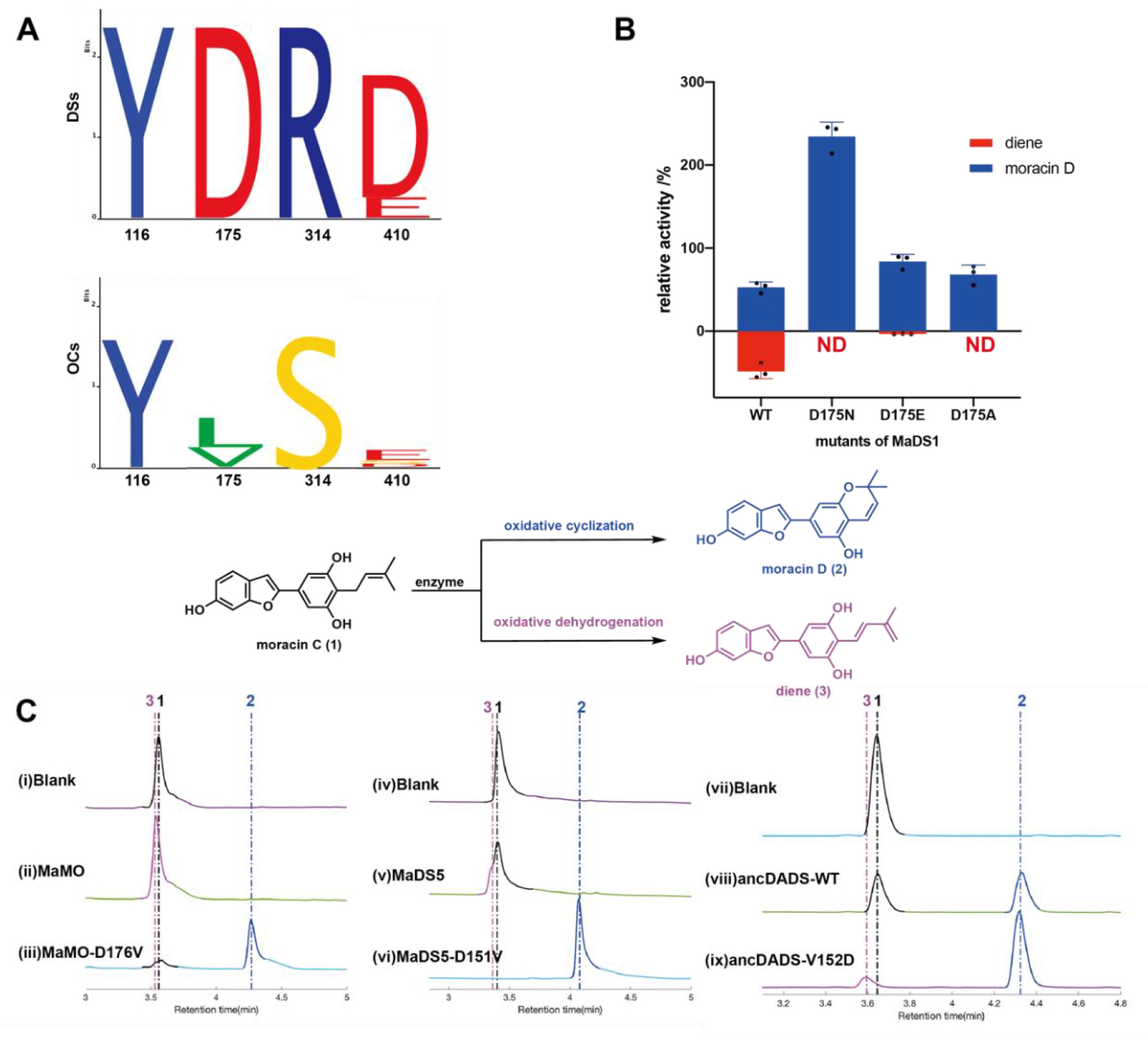
圖2.D175是對于氧化環化反應至關重要的氨基酸殘基
最后,作者密度泛函理論(DFT)計算以深入探究氧化反應的分子機制:該反應首先發生底物向FAD的負氫轉移,形成烯丙基碳正離子中間體,隨后在有無D175的參與的情況下有兩條反應路徑。沒有D175參與的情況下,中間體去質子化形成醌式中間體,該中間體隨后可以發生一步在空腔外自發的6π電環化反應得到氧化環化的產物(能壘22.0 kcal/mol),分子動力學(MD)模擬也表明該中間體無法在酶口袋內穩定存在,印證了這一結論;而另一條路徑則是通過D175對于碳正離子中間體去質子化,隨后形成了氧化脫氫產物(能壘22.3 kcal/mol)。該計算結果解釋了MaDS1對氧化環化的選擇性高于氧化脫氫(圖3)。
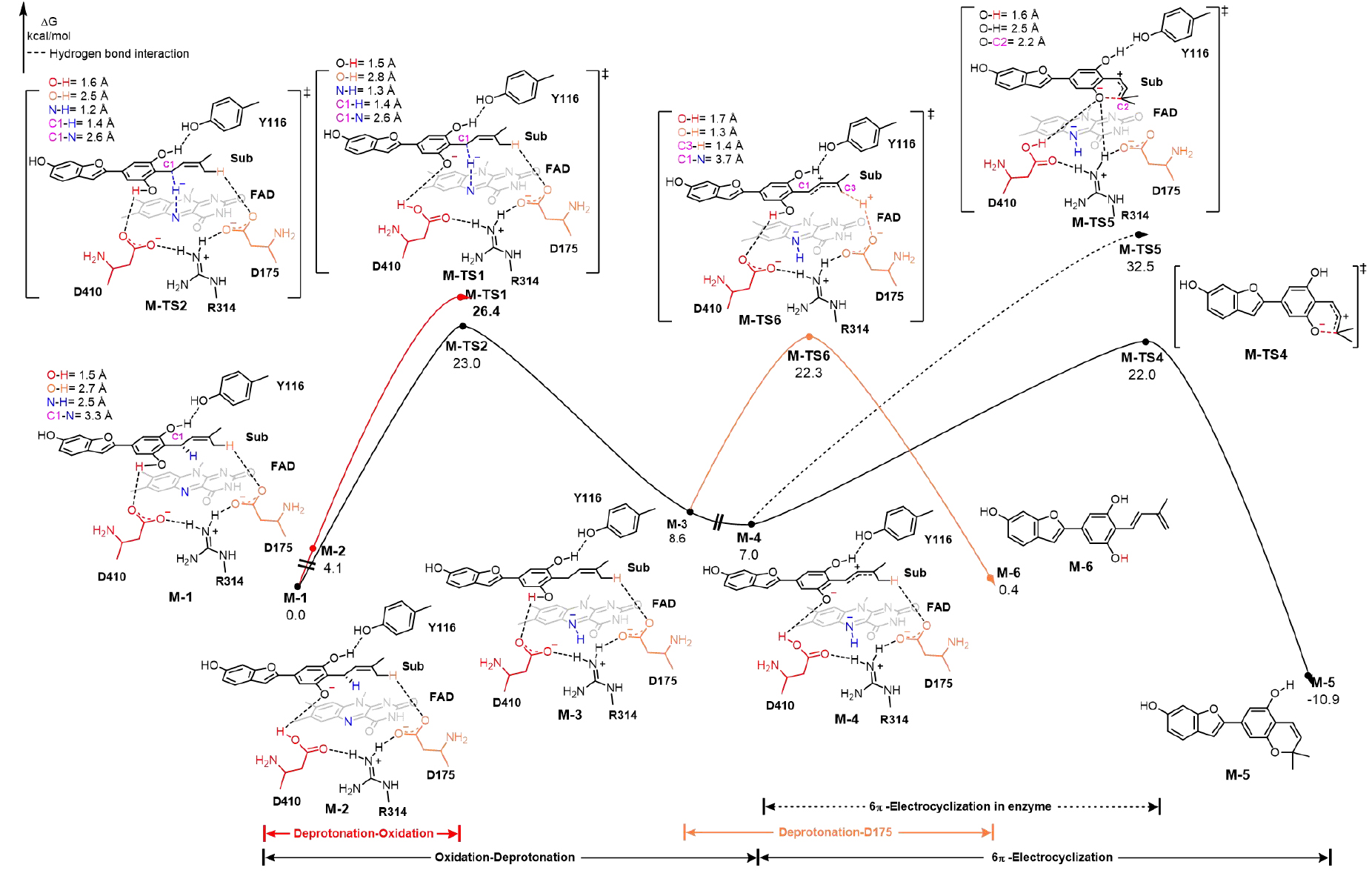
圖3.MaDS1催化氧化環化及氧化脫氫反應的DFT計算
總結
北京大學雷曉光課題組博士研究生郭念昕和南京理工大學的博士研究生顧軍為本文的共同第一作者,北京大學雷曉光教授,加州大學洛杉磯分校K. N. Houk教授和原北京大學雷曉光團隊副研究員,現武漢大學高磊教授為論文的共同通訊作者。該工作得到了國家重點研發計劃、國家自然科學基金委員會、The National Science Foundation of the US、北京分子科學國家研究中心、北大-清華生命科學聯合中心、新基石基金會等項目或單位的資助。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn